Терапия с применением CAR-Т клеток, предполагающая использование Т-лимфоцитов с химерным антигенным рецептором, продемонстрировала свою эффективность в лечении ряда онкогематологических заболеваний, таких как В-клеточные неходжкинские лимфомы и острый лимфобластный лейкоз. В настоящее время ведется работа по разработке и совершенствованию CAR-Т клеток для лечения ХЛЛ.
При ХЛЛ высоким лечебным потенциалом обладает трансплантация аллогенных гемопоэтических стволовых клеток (алло-ТГСК). Однако из-за преклонного возраста большого количества пациентов с ХЛЛ и наличия у таких пациентов множества сопутствующих заболеваний, трансплантация часто становится невозможной.
CAR-Т-клеточная терапия, предполагающая использование Т-лимфоцитов с химерным антигенным рецептором (CAR) в настоящее время привлекает все большее внимания из-за ее многообещающих результатов. Т-клетки, несущие химерный антигенный рецептор (клетки CAR-Т), производятся с помощью методов генной инженерии.
Преимущество CAR-T клеток по сравнению с обычными T-клетками пациента заключается в том, что они могут идентифицировать антигены независимо от главного комплекса гистосовместимости. При этом уничтожение лейкозной клетки происходит с помощью цитотоксических эффекторных механизмов.
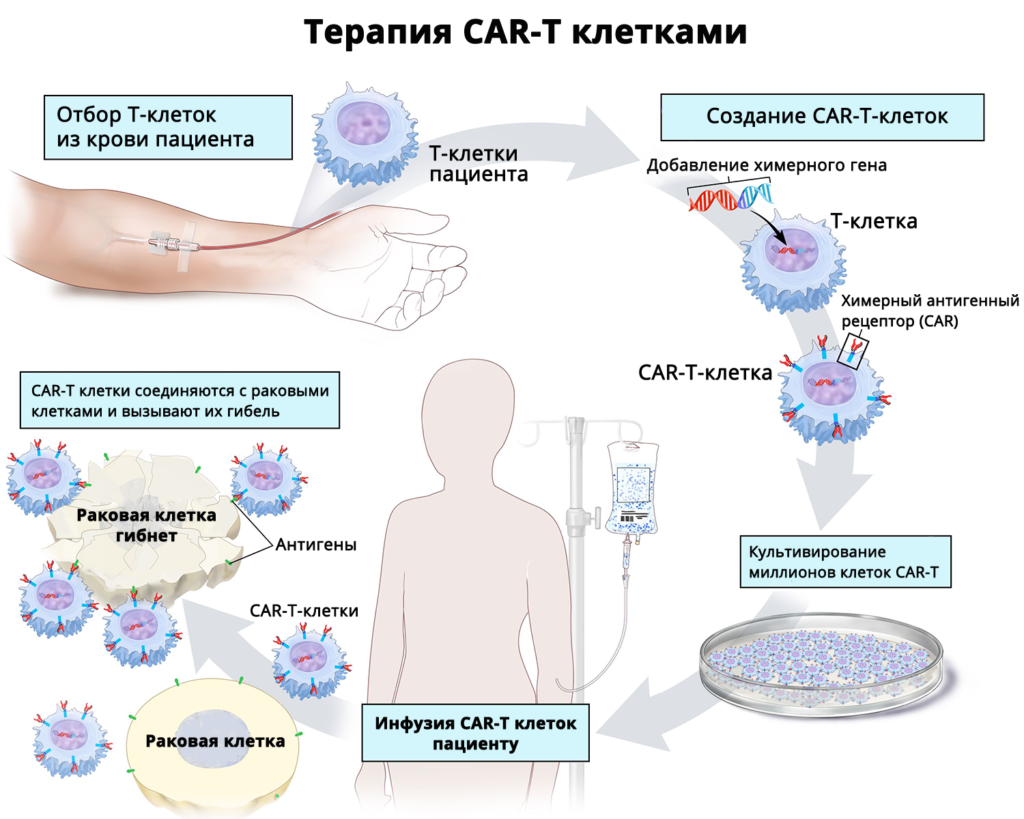
Как работает терапия CAR-T
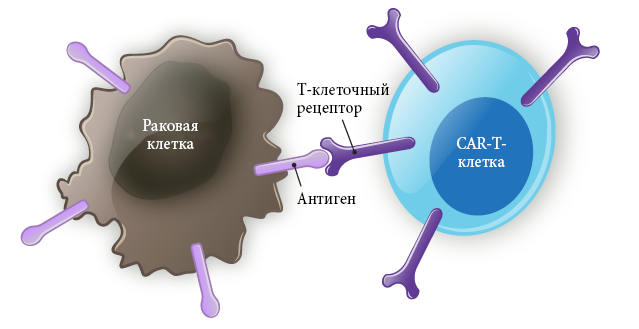
Антигены — это вещества, которые активируют иммунную систему. Иммунная система помогает организму бороться с инфекциями и другими болезнями. С помощью Т-клеток наша иммунная система распознает, какие антигены не принадлежат организму.
Т-клетки — это разновидность лимфоцитов. CAR-T-клетки — это Т-клетки, которые были генетически модифицированы в лабораторных условиях для того, чтобы связываться с антигенами на опухолевых (лейкозных) клетках. Когда CAR-Т-клетка связывается с опухолевой клеткой, иммунная система посылает иммунные клетки других видов уничтожить опухолевую клетку и тем самым убрать ее из организма.
При аутогенной терапии CAR-T-клетками у пациента из периферической крови берутся его Т-клетки. Далее они направляются в лабораторию, где к ним добавляется химерный ген. Этот процесс называют генетической модификацией. Химерный ген помогает Т-клеткам находить и уничтожать раковые клетки. После добавления такого нового гена T-клетки называются CAR-T-клетками. Генная модификация Т-клеток производится с помощью специальных препаратов.
Когда CAR-T-клетки будут готовы, пациенту вводят низкие дозы химиопрепаратов. Это помогает подготовить организм, чтобы максимально повысить эффективность CAR-T-клеток. Когда организм будет готов, CAR-T-клетки вольют (введут) в кровоток.
Примерная схема проведения CAR-T терапии:
Забор Т-клеток выполняется за 1–2 недели до инфузии. Процедура забора клеток длится около 2–4 часов. Далее клетки направляются в лабораторию, где в течении нескольких недель проходят модификацию. Когда CAR-T-клетки будут готовы и поступят в клинику, пациенту проводят курс подготовительной ХТ. Химиотерапевтическая лимфодеплеция проводится примерно за 3 дня до введения клеток CAR-T. CAR-T-клетки вводятся в кровоток путем обычной инфузии. Инфузия CAR-T-клеток длится около 30 минут. Ранний период выздоровления длится около 4 недель с момента инфузии. Выздоровление в долгосрочной перспективе длится примерно 100 дней с момента инфузии или дольше.
Самые эффективные CAR-Т-клетки, разработанные к настоящему времени и направленные против CD19, это Тисагенлеклейцел и Аксикабтаген Силолейцел. Препараты были одобрены для применения в США и Европе в 2017–2018 годах.
Аксикабтаген Силолейцел зарегистрирован только для терапии ДВКЛ.
Тисагенлеклейцел (Кимрая , Kymriah, Tisaglenlecleucel – производитель Novartis) рекомендуется для лечения пациентов в возрасте до 25 лет с рефрактерным острым лимфобластным лейкозом (ОЛЛ) и взрослых пациентов с диффузной B-крупноклеточной лимфомой (ДВКЛ) при рецидивах или резистентности к стандартной ИХТ.
Кимрая (тисагенлеклейцел) – это препарат для аутологичной, иммуноклеточной противоопухолевой терапии, включающей перепрограммирование собственных Т-лимфоцитов пациента с использованием трансгена, кодирующего химерный антигенный рецептор (CAR), с целью обнаружения и элиминации клеток, экспрессирующих CD19. CAR-рецептор состоит из фрагмента мышиного одноцепочечного антитела, распознающего CD19, который слит с внутриклеточными сигнальными доменами из 4-1ВВ (CD137) и CD3 zeta.

Стоимость этого препарата около 500 000 USD.
Эффективность терапии CAR-T
ХЛЛ был одним из первых заболеваний, при которых использовались клетки CAR-Т. Однако опыт применения этого метода лечения в настоящее время наиболее широкий при ОЛЛ и ДВКЛ. Доклинические и клинические исследования показывают, что CAR-T-клеточная терапия может использоваться как способ лечения пациентов с рецидивами и рефрактерным течением ХЛЛ.
Причиной недостаточного ответа на терапию CAR-T считается глубокая иммунная модуляция при ХЛЛ, при которой иммунные эффекторные клетки, которые необходимы для успешной терапии, такие как T-лимфоциты CD4+ и CD8+, имеют фенотипические и функциональные дефекты.
Однако данные о том, что в настоящее время есть пациенты с устойчивой ремиссией в течение более 8 лет после однократной инфузии CAR-Т клеток, подтверждают, что этот подход может быть высокоэффективным по крайней мере у некоторой части пациентов с рецидивами и резистентным ХЛЛ.
Со времени первого сообщения об эффективности CAR-Т-клеток при ХЛЛ в 2011 г. были опубликованы результаты более 15 исследований применения CAR-Т-клеточной терапии в общей сложности более чем у 130 пациентов с ХЛЛ. В большинстве исследований использовались конструкции, распознающие CD19 на опухолевых клетках и содержащие домены костимуляции CD28 или 4-1BB.
Пациенты, принимавшие участие в этих исследованиях, имели особенно плохой прогноз, большинство из них были с рецидивами после большого количества линий предшествующей терапии. Около половины пациентов получали ибрутиниб, около 20 % — венетоклакс, некоторые пациенты находились в стадии рецидива после аллоТГСК. Кроме того, около 70 % больных имели изменения р53, а 60 % обследованных — комплексный кариотип.
Анализ представленных данных показывает, что примерно 50–70 % пациентов с ХЛЛ имели ответ на CAR-T-клеточную терапию, при этом полный ответ был получен у 20–30 % больных. Выживаемость без прогрессирования оценивается в 25 % через 18 мес. В рандомизированном исследовании II фазы по оптимизации дозы было показано, что более высокая доза CAR-T клеток (5 × 108 против 5 × 107) дает более высокие показатели общего и полного ответов.
По сравнению с данными об эффективности CAR-T-клеточной терапии при ОЛЛ и ДВКЛ результаты при ХЛЛ оказываются ниже: частота полной ремиссии при ХЛЛ составляет 20–30 vs 70 % при ОЛЛ и 50 % при ДВКЛ. Однако, несмотря на то что число пациентов, у которых достигается полный ответ, невысокое, прогноз у этих больных благоприятный, с низкой вероятностью рецидивов. По этой причине в настоящее время главной задачей CAR-Т-клеточной терапии у пациентов с ХЛЛ является повышение частоты полных ответов.
Побочные эффекты CAR-T
Синдром цитокинового шторма (СЦШ), В-клеточная аплазия, нейротоксичность и инфекции являются частыми побочными эффектами CAR T-клеточной терапии при ХЛЛ [50–52]. Частота СЦШ относительно высокая при ХЛЛ и составляет почти 83 %, наиболее часто СЦШ встречается у пациентов, которые ранее принимали ибрутиниб. Однако комбинация ибрутиниба и CAR Т-клеток, по-видимому, связана с более низкой частотой возникновения СЦШ ≥ III степени тяжести.
При цитокиновом шторме возможно поражение с нарушением функции разных органов и систем. Клинические симптомы при СЦШ могут быть различными: лихорадка, нарушение дыхательной функции, тахикардия, гипотензия, генерализованные отеки, нарушение сознания, генерализованная лимфаденопатия, гепатоспленомегалия, эритематозная или зудящая сыпь. Тяжесть течения СЦШ варьирует и может достигать уровня полиорганной недостаточности с летальным исходом. Для лечения применяются антагонист рецептора IL-6 тоцилизумаб и кортикостероиды.
Поскольку CD19 широко экспрессируется на B-клетках, анти-CD19 CAR-T-клетки могут уничтожать как клетки ХЛЛ, так и нормальные B-лимфоциты, вызывая аплазию B-клеток, которая характеризуется дефицитом B-клеток и иммуноглобулина. Возможным решением этой проблемы является заместительная терапия иммуноглобулином для внутривенного введения.
У некоторых пациентов с ХЛЛ отмечается неврологическая токсичность, механизм развития которой остается неясным. Нейротоксичность I–III и IV–V степени тяжести при ХЛЛ встречается у 29 и 4 % пациентов соответственно. Как правило, ее симптомы включают делирий, афазию, судороги и т. д. Следует отметить, что большая часть неврологической токсичности обратима и может спонтанно разрешаться без какого-либо лечения. При тяжелой нейротоксичности рекомендуется использовать высокие дозы кортикостероидов. Кроме того, возможно применение анти-IL-6-антител (тоцилизумаб) при неврологической токсичности с одновременным СЦШ.
Инфекции также бывают тяжелыми побочными эффектами при CAR T-клеточной терапии из-за гипогаммаглобулинемии и нейтропении. Частота возникновения инфекционных осложнений III степени тяжести и выше при ХЛЛ составляет 21–25 %. Бактерии — наиболее частая причина, но также встречаются вирусные и грибковые инфекции. Факторами высокого риска инфекции являются число (> 4) предыдущих схем противоопухолевого лечения, высокая доза CAR T-клеток и высокая степень тяжести СЦШ/нейротоксичности. При возникновении инфекционных осложнений применяют антибиотики, противогрибковые и противовирусные средства.
Проблемы CAR-T терапии
Несмотря на то что терапия на основе CAR-Т-клеток может быть очень эффективной, она имеет существенные недостатки. Во-первых, получение аутологичного продукта может быть затруднено из-за недостаточного количества Т-клеток, особенно у пациентов с большим объемом предшествующего противоопухолевого лечения. Во-вторых, достаточно длительное время производства CAR-T-клеток делает лечение невозможным у пациентов с агрессивными злокачественными опухолями. Кроме того, CAR-Т-клеточная терапия связана с серьезными побочными эффектами.
Одной из основных проблем также является чрезвычайно высокая стоимость производства аутологичных Т-клеток индивидуально для каждого пациента. Общие затраты могли бы быть снижены за счет использования аллогенных Т-клеток. Однако подобная терапия может обусловить риск опасных для жизни осложнений, связанных с реакцией «трансплантат против хозяина».
При подготовке этой статьи использованы материалы:
1. Грибкова И.В., Завьялов А.А. “CAR Т-клетки для лечения хронического лимфоцитарного лейкоза: обзор литературы”. Клиническая онкогематология. 2021;14(2):225–30.