Хронический лимфолейкоз относится к лимфопролиферативным заболеваниям и характеризуется накоплением моноклональных CD5+ В-лимфоцитов. Опухолевый клон ХЛЛ выявляется в крови, костном мозге, лимфатических узлах, печени, селезенке и других органах. Общий иммунофенотипический признак В-клеточных ЛПЗ – обнаружение рестрикции лёгких цепей kappa или lambda поверхностных иммуноглобулинов, что служит подтверждением клональности В-лимфоцитов при опухолевой трансформации.
ВНИМАНИЕ!
Данный материал представляет собой анализ ранее проведённых исследований и наблюдений за течением болезни у пациентов с ХЛЛ. Нельзя однозначно относить эти сведения к прогностическим. Соотношения свободных цепей kappa/lambda, наличие и уровни моноклональной секреции Ig при ХЛЛ – не включены в официальные прогностические индексы и модели!
Главные тезисы:
| • Рестрикция лёгкой цепи Kappa или Lambda – главный признак клональности клеток ХЛЛ, однако иногда встречаются клоны ХЛЛ без такой рестрикции. |
| • ХЛЛ CD19+Kappa представлен мелкими, однотипными, более зрелыми клетками. |
| • ХЛЛ CD19+Lambda представлен клетками разных размеров, полиморфными, менее зрелыми и промежуточными. |
| • При клональности по цепи Lambda, в костном мозге может наблюдаться более выраженный лимфоцитoз. |
| • У большинства пациентов клональность ХЛЛ совпадает с изотипом СЛЦ в крови. |
| • Основными продуцентами СЛЦ являются плазмацитоидные лимфоциты. |
| • Белок Бенс-Джонса при ХЛЛ секретируется, но значительно меньше, чем при парапротеинемиях. |
| • Моноклональные СЛЦ в крови и их аномальные соотношения – факторы неблагоприятного прогноза. |
| • Пациенты с аномальным соотношением СЛЦ Ig в крови значительно чаще имеют немутированный IGHV. |
Используемые сокращения:
Ig – иммуноглобулин
CD – кластер дифференцировки
СЛЦ – свободные лёгкие цепи
ИС СЛЦ – изменённое соотношение СЛЦ
ОВ – общая выживаемость
ВБП – выживаемость без прогрессии
ВНТ – время до начала терапии
ИГХ – иммуногистохимия
ИФТ – иммунофенотипирование
ИХТ – иммунохимиотерапия
Клональность по цепям Kappa / Lambda
В современной диагностике ХЛЛ выявление иммунофенотипа опухолевой популяции осуществляется методом многоцветной проточной цитометрии крови/костного мозга. Опухолевые клетки ХЛЛ обычно экспрессируют антигены – CD19, CD5, CD23, CD20 (dim), CD22 (dim), CD43, CD200. В-клеточная клональность устанавливается определением соотношения экспрессии k- (kappa) и λ- (lambda) легких цепей иммуноглобулинов (Ig).
Молекула CD19 экспрессирована на поверхности всех B-клеточных линий, от ранних предшественников B-клеток до зрелых B-лимфоцитов. В результате дифференцировки в плазмоциты клетки перестают экспрессировать CD19. T-лимфоциты, NK-клетки, моноциты и гранулоциты не экспрессируют CD19.
Легкая kappa-цепь Ig экспрессируется на поверхности клеточной субпопуляции, составляющей примерно 2/3 зрелых B-лимфоцитов периферической крови и незрелых B-лимфоцитов костного мозга.
Легкая lambda-цепь Ig экспрессируется на поверхности клеточной субпопуляции, составляющей примерно 1/3 зрелых B-лимфоцитов периферической крови и незрелых B-лимфоцитов костного мозга.
Отношение числа клеток, экспрессирующих kappa-цепи, к числу клеток, экспрессирующих lambda-цепи (соотношение каппа / лямбда), также позволяет отличить вторичный гиперлимфоцитоз от лимфопролиферативных заболеваний. Во вторичных популяциях B-клеток соотношение каппа/лямбда находится в пределах от 1/1 до 2/1, в то время как для клональной пролиферации B-клеток оно обычно больше 4/1 или меньше 1/2.
Анализ моноклональности B-клеток помогает диагностировать: ХЛЛ и ЛМЛ, пролимфоцитарный лейкоз, лимфому из клеток мантии, фолликулярную лимфому, лимфому маргинальной зоны, а также волосатоклеточный лейкоз.
Моноклональными обычно считаются варианты, при которых отношение клеток CD19+ kappa/lambda составляет более 4:1 или менее 1:2. Однако у 10-15% больных с ХЛЛ рестрикция по мембранным лёгким цепям Ig может отсутствовать.
Морфология В-клеток ХЛЛ
На основании цитологических признаков клеток лимфоидного ряда в FAB-классификации выделяют два морфологических варианта B-XЛЛ: типичный, представленный однообразными небольшими лимфоцитами, и смешанно-клеточный, в котором субстрат опухоли неоднороден и состоит из клеток с различными морфологическими признаками – типичных и атипичных лимфоцитов, пролимфоцитов.
У пациентов с клональностью ХЛЛ по цепи Kappa (CD19k+ CD5+ CD23+) лимфоидные клетки крови и КМ представлены мелкими однотипными клетками, со скудной цитоплазмой. Ядра этих клеток имеют глыбчатую структуру хроматина, без отчетливых нуклеол. В распределении опухолевых В-клеток наблюдается морфологическая однотипность.
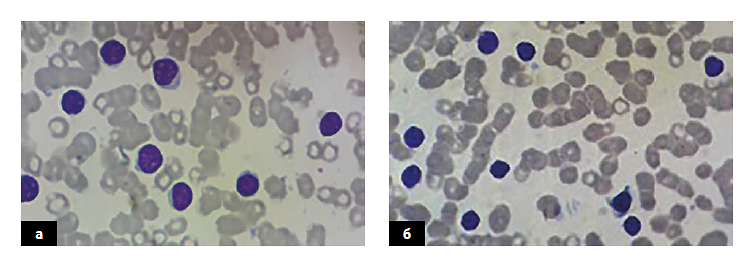
А – кровь, Б – костный мозг.
У пациентов с клональностью ХЛЛ по цепи Lambda (CD19λ+ CD5+ CD23+) размеры клеток лимфоидной популяции крови и КМ варьируются от малых до крупных, с обильной цитоплазмой. Ядра таких клеток имеют округлую или складчатую форму, сглаженную структуру хроматина, 1–2 нуклеолы (ядрышка). В распределении опухолевых В-клеток наблюдается морфологический полиморфизм.
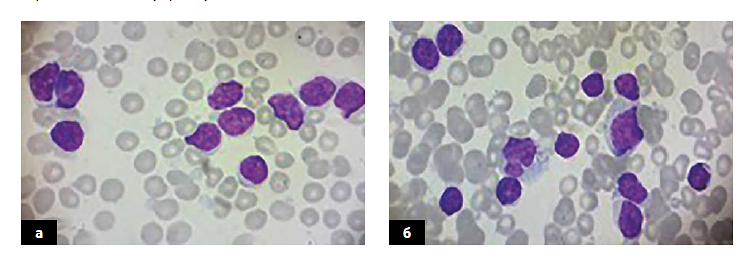
А – кровь, Б – костный мозг.
В исследовании [1] показано, что в случаях смешанно-клеточного варианта В-ХЛЛ клиническое состояние, восприимчивость к терапии и продолжительность жизни пациентов имеют несколько худшие характеристики по сравнению с типичным вариантом заболевания.
Особенности Kappa и Lambda вариантов ХЛЛ
Методом проточной цитофлуориметрии выявляются различия в экспрессии общелейкоцитарного антигена CD45 в группах клеток Kappa или Lambda. Известно, что уровень экспрессии CD45 нарастает по мере дифференцировки гемопоэтических клеток от незрелых предшественников до зрелых форм.
Клетки с минимальной экспрессией CD45 – это бласты, промежуточным уровнем экспрессии обладают клетки миелоидного ряда, а зрелые лимфоциты отличаются максимальным уровнем экспрессии антигена CD45.
С учётом этих особенностей было установлено, что в популяции Kappa (CD19k+ CD5+ CD23+) опухолевый клон представлен зрелыми клетками и высоким уровнем экспрессии CD45, а в популяции Lambda (CD19λ+ CD5+ CD23+) – менее зрелыми и/или промежуточными формами клеток и менее высоким уровнем CD45.
В крови пациентов из групп Kappa и Lambda отсутствуют значимые различия в уровнях лейкоцитов и лимфоцитов, однако число лейкоцитов в группе Kappa может быть незначительно выше.
У пациентов группы Lambda чаще может наблюдаться более выраженная лимфоидная инфильтрация костного мозга и, как следствие, более выраженное угнетение гранулоцитарного и эритроидного ростков кроветворения. Также, в крови пациентов группы Lambda могут выявляться пролимфоциты, составляющие в среднем до 8% от общего уровня лейкоцитов.
В исследовании [1] активационный антиген CD38 выявлялся вариабельно: в Kappa-группе экспрессия определялась на уровне от 0,1% до 95%, в Lambda-группе от 0,5% до 69%. Высокий уровень экспрессии CD38 является маркером прогрессии заболевания, индикатором активации и пролиферации клеток ХЛЛ. Экспрессия СD38 на более чем 20% CD19+CD5+ клеток, может быть ассоциирована с плохим прогнозом.
Других существенных отличий в экспрессии антигенов (CD или кластеров дифференцировки) между лимфоцитами клональными по цепям Kappa и Lambda не отмечено.
Связь между клональностью клеток ХЛЛ и СЛЦ
Повышенный уровень СЛЦ (свободных лёгких цепей) с аномальным соотношением kappa/lambda, вероятно, вызван секрецией клональных СЛЦ из опухолевых клеток ХЛЛ.
В исследовании [4] у пациентов как с повышенным уровнем СЛЦ, так и с аномальным соотношением СЛЦ kappa/lambda (с моноклональным увеличением СЛЦ), доминирующий сывороточный тип СЛЦ соответствовал лёгкой цепи клона B-клеток ХЛЛ в 96% случаев.
Среди пациентов с аномальным соотношением СЛЦ kappa/lambda, но без повышения абсолютного уровня СЛЦ, доминантная лёгкая цепь в сыворотке соответствовала лёгкой цепи клона B-клеток ХЛЛ в 92% случаев.
У пациентов с повышенным уровнем СЛЦ, но с нормальным соотношением kappa/lambda (с поликлональным увеличением СЛЦ), более обильные сывороточные СЛЦ соответствовали лёгкой цепи клона B-клеток ХЛЛ в 75% случаев.
В исследовании [5] у большинства пациентов клональность по СЛЦ совпадала с изотипом легких цепей Ig клональных В-лимфоцитов ХЛЛ, установленным при ИФТ исследовании. У незначительной части пациентов не было выявлено клонального характера концентраций СЛЦ, хотя была обнаружена рестрикция по λ-типу легкой цепи на мембране клональных В-лимфоцитов.
Свободные лёгкие цепи Ig
Сывороточная концентрация свободных легких цепей (СЛЦ) зависит от баланса между их продукцией плазматическими клетками и их предшественниками и почечным клиренсом. При повышении поликлональных иммуноглобулинов или снижении почечной функции концентрация свободных легких цепей как каппа-, так и лямбда-типа может повышаться в 30–40 раз, однако относительная концентрация каппа- и лямбда-цепей остается неизменной.
Лимфатические опухоли в избытке продуцируют легкие цепи только одного изотипа и нередко подавляют продукцию альтернативной легкой цепи в костном мозге. В связи с этим соотношение легких цепей каппа и лямбда меняется. Точное измерение соотношения легких цепей каппа и лямбда в сыворотке дает количественный показатель клональности. Период полувыведения свободных легких цепей из крови очень непродолжителен. Для каппа-цепи это 2–4 часа, для лямбда-цепи это 3–6 часов.
Различие связано с тем, что цепи каппа-типа обычно мономерные, в то время как цепи лямбда-типа образуют димеры, соединенные дисульфидными мостиками: мономерные цепи каппа-типа удаляются быстрее димерных цепей лямбда-типа. При незначительных различиях в скорости выведения легких цепей это примерно в 100–200 раз меньше, чем период распада полноразмерной молекулы иммуноглобулина G, который составляет 21 день, поэтому ответ на лечение можно оценить сразу или значительно быстрее, чем по уровню белка или моноклонального парапротеина.
Рестрикция лёгкой цепи – это преимущественное продуцирование одного из двух типов легких цепей kappa или lambda, с подавлением (рестрикцией) синтеза другой цепи. В результате рестрикции соотношение κ-СЛЦ / λ-СЛЦ значительно изменяется.
В исследовании Maurer MJ et al. установлено три типа нарушений синтеза СЛЦ Ig сыворотки крови при ХЛЛ. Первое выражается в моноклональном увеличении концентрации κ-СЛЦ или λ-СЛЦ, определяемом по измененному κ/λ-отношению. Второе – в поликлональном увеличении концентрации СЛЦ (увеличении концентрации kappa и/или lambda с нормальным κ/λ-отношением). Третье нарушение характеризуется измененным κ/λ-отношением без увеличения концентрации k-СЛЦ или λ-СЛЦ.
Отмечается уменьшение времени до начала терапии и общей выживаемости в группе больных ХЛЛ с измененным κ/λ-отношением СЛЦ по сравнению с больными с нормальной концентрацией СЛЦ Ig сыворотки крови.
СЛЦ Ig в крови
В норме, продукция СЛЦ происходит на всех этапах развития B-лимфоцитов, достигая максимума в плазматических клетках. У здоровых людей ежедневно образуется примерно 500 мг свободных легких цепей. Они продуцируются клетками как костного мозга, так и лимфатических узлов. Плазматические клетки продуцируют один из пяти изотипов тяжелых цепей вместе с молекулами kappa и lambda.
Лёгкие цепи Ig продуцируются в избытке и их количество превосходит тяжёлые цепи Ig примерно на 40%. Это важно для правильной сборки интактной молекулы иммуноглобулина. 70% всех плазматических клеток продуцирует kappa-цепь и 30% – lambda-цепь, что связано с порядком перестроек генов иммуноглобулинов в лимфоцитах.
Механизм продукции СЛЦ Ig клетками ХЛЛ до конца не ясен. Эта продукция может объясняться активацией какого-либо внутриклеточного пути. Возможно и более простое объяснение – данный феномен косвенно отражает пролиферативную активность опухоли. Клетки ХЛЛ обладают довольно высокой пролиферативной активностью, но она сосредоточена исключительно в пролиферативных центрах. Деление клеток ХЛЛ происходит при постоянной антигенной стимуляции, которая может усиливать продукцию СЛЦ.
В пользу этой гипотезы свидетельствует тот факт, что антигенная стимуляция при аутоиммунных заболеваниях сопровождается избыточной продукцией СЛЦ. Лёгкие цепи могут принимать участие в тканевых реакциях. Например, они могут активировать тучные клетки, которые обогащают микроокружение ХЛЛ. Активированные тучные клетки могут, в свою очередь, поддерживать рост опухолевых клеток и содействовать иммунной стимуляции посредством различных путей, включая CD40- и IL-6-опосредованную передачу сигнала.
Morabito и соавт. наряду с исследованием СЛЦ в сыворотке провели ИГХ исследования с этими же антителами и показали, что основными продуцентами СЛЦ являются содержащиеся в инфильтратах плазмацитоидные лимфоциты и в меньшей степени лимфоциты, не обладающие плазмацитоидными чертами.
При определении СЛЦ Ig сыворотки крови при ХЛЛ целесообразно использовать молекулярный иммунохимический метод FreeLight, чувствительность которого значительно выше электрофореза или иммунофиксации. Изменение концентрации СЛЦ или клональный характер κ/λ-отношения при использовании FreeLight выявляются значительно чаще.
Принцип действия метода FreeLight основан на взаимодействии антисыворотки с СЛЦ Ig типа kappa и lambda. В норме отношение концентраций kappa и lambda в крови составляют диагностический интервал 0.26 – 1.65. Нарушение этого соотношения является “маркером” пролиферации одного из клонов клеток. Порог обнаружения kappa СЛЦ составляет – 1.5 мг/л, lambda СЛЦ – 3 мг/л (при электрофорезе белков крови – 500–2000 мг/л, при иммунофиксации – 150–500 мг/л).
При В-клеточном ХЛЛ почти у 60% пациентов обнаруживается аномальное соотношение СЛЦ Ig сыворотки крови. При комплексной оценке β2-микроглобулина и соотношения СЛЦ возможно получение значимых данных при дифференциальной диагностике ХЛЛ, оценке минимальной остаточной болезни после 2–4 циклов ИХТ или рефрактерности к ИХТ. Данная оценка основывается на том, что примерно у 50% больных с ХЛЛ диагностируется клональный тип изменений СЛЦ (чаще Kappa-изотипа) и в исследованиях было установлено, что достижение клинико-гематологической и иммунофенотипической ремиссии, после проведения ИХТ, у больных с клональным типом СЛЦ сопровождалось нормализацией их концентрации, а также kappa/lambda соотношения.
Важно отметить, что у 30% пациентов, при достижении иммунофенотипической ремиссии (число остаточных клеток ХЛЛ в пределах 0.01 … 1%), СЛЦ сохраняли опухолевую клональность.
Белок Бенс-Джонса и Ig в крови
В связи с тем, что в норме В-лимфоциты являются предшественниками клеток-антителопродуцентов, у части больных ХЛЛ опухолевые лимфоциты сохраняют способность синтезировать моноклональные иммуноглобулины (Ig). Это подтверждается исследованиями, обнаружившими М-градиент при электрофорезе и иммунофиксации белков сыворотки крови.
При анализе соотношения СЛЦ было установлено, что kappa-цепь секретируется в 5 раз чаще, чем lambda. При анализе продукции белка Бенс-Джонса было установлено иное соотношение. Белок Бенс-Джонса kappa-типа, при стандартном иммунохимическом исследовании, выявляется почти в 7 раз чаще, чем белок lambda-типа.
Если говорить о продукции полноразмерных иммуноглобулинов, то при ХЛЛ у пациентов примерно с одинаковой частотой выявляется секреция IgM и IgG и значительно реже обнаруживается секреция IgA.
Уровень продукции как белка Бенс-Джонса, так и полноразмерных Ig при ХЛЛ значительно ниже, чем при парапротеинемических гемобластозах, таких как моноклональная гаммапатия неясного генеза (MGUS), множественная миелома (ММ) или макроглобулинемия Вальденстрёма (МВ).
При отсутствии экспрессии антигенов CD5- или CD23- на В-клетках ХЛЛ, в крови пациентов часто наблюдается более высокая экспрессия поверхностного IgM. Наличие такой моноклональной секреции не является показанием к началу терапии ХЛЛ.
Прогностическое значение моноклональных СЛЦ
При оценке прогностического значения изменённого соотношения СЛЦ (ИС СЛЦ) в исследовании [2] установлено, что этот показатель ассоциируется с неблагоприятным прогнозом у пациентов с ХЛЛ. Интересно, что большее прогностическое значение имел факт наличия моноклональной секреции, выявляемой при стандартном иммунохимическом исследовании. Различия в ОВ пациентов были достоверны при сравнении по факту наличия или отсутствия секреции. Этот факт свидетельствует о том, что количество продуцируемых легких цепей имеет значение.
В нескольких исследованиях было установлено, что продукция моноклональных СЛЦ существенно реже выявляется в стадии А и чаще в стадии С, что говорит о её связи с массой опухоли. У больных с ИС СЛЦ необходимость в лечении обычно возникает раньше, что говорит об активности опухоли. Чем выше уровень β2-микроглобулина (более 3 мг/л), тем чаще выявляется продукция моноклональных СЛЦ. Среди пациентов с ИС СЛЦ значительно больше пациентов с немутированными VH-генами.
В исследовании [3] также было показано, что наличие моноклональных СЛЦ в сыворотке крови является фактором неблагоприятного прогноза.
Прогностическое значение поликлональных СЛЦ
У больных с поликлональным типом СЛЦ в исследовании [3] неблагоприятный прогноз определяется только высокой суммой κ+λ СЛЦ. Суммарное количество СЛЦ (κ+λ более 60.6 мг/л) характеризуется риском короткого времени до начала терапии. У пациентов с нормальными концентрациями СЛЦ отклонение κ/λ отношения с акцентом на λ-изотип ассоциировано с уменьшением ВНТ. Таким образом, это исследование подтверждает, что выявление моноклональных и поликлональных параметров СЛЦ может быть использовано для определения прогноза у пациентов с ХЛЛ.
В исследовании [6] было установлено, что за 10 лет до постановки диагноза ХЛЛ: у 38% пациентов наблюдалось аномальное соотношение κ/λ СЛЦ, а еще у 16% наблюдалось поликлональное повышение уровней СЛЦ, у 13% пациентов в крови выявлялись моноклональные М-белки.
При этом, преддиагностические М-белки были более распространены среди молодых пациентов с ХЛЛ и значительно чаще выявлялись у мужчин, чем у женщин. Эти показатели существенно выше, чем распространенность аномальных соотношений СЛЦ и М-белков среди населения в целом в возрасте 50+ лет (по сообщениям ~ 2%-3%). Эти данные подтверждают роль хронической иммунной стимуляции в генезе ХЛЛ.
Исследование Pratt et al. установило, что пациенты с аномальным соотношением СЛЦ Ig в крови значительно чаще имели немутированный IGHV, время удвоения лимфоцитов менее 12 месяцев и высокий уровень β2-микроглобулина. Для пациентов с ХЛЛ с немутированными генами IGHV изменённое соотношение κ/λ было неблагоприятным прогностическим фактором.
Аналогичным образом, в исследовании Perdigao et al. показана корреляция между аномальным соотношением СЛЦ, ВНТ, мутационным статусом и ОВ. В исследовании Ruchlemer et al. у пациентов с ХЛЛ на различных стадиях обнаруживали аномальное соотношение СЛЦ в 53% случаев, что в основном коррелировало с поздней стадией заболевания и увеличением продукции kappa-цепи. Помимо более частого обнаружения М-белка при ХЛЛ, в исследовании было показано, что аномально низкий уровень СЛЦ (указывающий на продукцию lambda-цепей) был также связан с худшим исходом.
Таким образом, изучение уровней, типов и соотношений СЛЦ в крови у пациентов с ХЛЛ, а также их комплексный анализ совокупно с другими показателями, такими как β2-микроглобулин, может дать новые возможности в определении прогноза ХЛЛ и в оценке эффективности его терапии.
При подготовке этой статьи использованы материалы:
[1]. Гуськова Н.К., Селютина О.Н., Новикова И.А., Максимов А.Ю., Ноздричева А.С, Абакумова С.В. “Морфологические и иммунофенотипические особенности моноклональной популяции В-лимфоцитов при ХЛЛ”. Южно-российский онкологический журнал. 2020; 1(3): 27-35. https://doi.org/10.37748/2687-0533-2020-1-3-3
[2]. Никитин Е.А. “Дифференцированная терапия хронического лимфолейкоза”. Диссертация на соискание ученой степени доктора медицинских наук. ФГБУ ГНЦ Минздрава РФ, Москва, 2014 г.
[3]. Голенков А.К., Митина Т.А., Клинушкина Е.Ф., Катаева Е.В., Чуксина Ю.Ю., Черных Ю.Б., Трифонова Е.В., Захаров С.Г., Высоцкая Л.Л., Белоусов К.А., Марьина С.А., Когарко И.Н., Савин А.О., Мадзяра О.П., Когарко Б.С. “Прогностическое значение поликлональных СЛЦ иммуноглобулинов сыворотки крови у больных ХЛЛ”. ГБУЗ МО “Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского”, Москва; Институт химической физики им. Н.Н. Семенова РАН, Москва; ФГБУ НМИЦ “Гематологии” МЗ РФ, Москва. ВЕСТНИК ГЕМАТОЛОГИИ, том XVIII, № 2, 2022.
[4]. Matthew J. Maurer, James R. Cerhan, Jerry A. Katzmann, Brian K. Link, Cristine Allmer, Clive S. Zent, Timothy G. Call, Kari G. Rabe, Curtis A. Hanson, Neil E. Kay, Susan L. Slager, Thomas E. Witzig, Tait D. Shanafelt; Monoclonal and polyclonal serum free light chains and clinical outcome in chronic lymphocytic leukemia. Blood 2011; 118 (10): 2821–2826. doi: https://doi.org/10.1182/blood-2011-04-349134
[5]. Катаева E.В., Голенков A.K., Митина T.A., Клинушкина E.Ф., Трифонова E.В., Высоцкая Л.Л., Черных Ю.Б., Чуксина Ю.Ю., Когарко И.H., Когарко Б.С., Марьина С.А., Белоусов К.A., Захаров С.Г. “Клинические аспекты определения свободных легких цепей иммуноглобулинов сыворотки крови у больных ХЛЛ”. Гематология и трансфузиология. 2017;62(3):153-157. https://www.htjournal.ru/jour/article/view/78
[6]. Tsai HT, Caporaso NE, Kyle RA, Katzmann JA, Dispenzieri A, Hayes RB, Marti GE, Albitar M, Ghia P, Rajkumar SV, Landgren O. “Evidence of serum immunoglobulin abnormalities up to 9.8 years before diagnosis of chronic lymphocytic leukemia: a prospective study”. Blood. 2009 Dec 3;114(24):4928-32. doi: 10.1182/blood-2009-08-237651