Разработка ингибиторов тирозинкиназы Брутона (BTK) и B-клеточной лимфомы 2 (BCL2) привела за последнее десятилетие к смене парадигмы в лечении ХЛЛ. Наблюдения относительно важности передачи сигналов B-клеточных рецепторов для выживания и пролиферации клеток ХЛЛ привели к разработке первого в своем классе ингибитора ВТК, Ибрутиниба, для лечения ХЛЛ. Несмотря на то, что ибрутиниб переносится лучше чем ИХТ, он имеет побочные эффекты, некоторые из которых связаны с нецелевым ингибированием киназ, отличных от ВТК.
В результате были разработаны более специфические ингибиторы ВТК, такие как акалабрутиниб и занубрутиниб, которые продемонстрировали эквивалентную или повышенную эффективность и улучшенную переносимость в крупных рандомизированных клинических исследованиях. Несмотря на повышенную специфичность ВТК, побочные эффекты и резистентность к лечению остаются терапевтическими проблемами. Поскольку все эти препараты ковалентно связываются с ВТК, альтернативным подходом была разработка нековалентных ингибиторов ВТК, включая пиртобрутиниб и немтабрутиниб. Альтернативные механизмы связывания этих агентов с ВТК потенциально способны преодолеть мутации резистентности, что было подтверждено данными ранних клинических испытаний.
Дальнейшим шагом в клиническом развитии ингибирования BTK стала разработка деструкторов BTK, которые разрушают BTK путем убиквитинирования и протеасомной деградации, что резко контрастирует с ингибированием BTK. В этой статье рассмотрена эволюция ингибирования BTK при ХЛЛ и перспективы секвенирования растущего числа различных агентов, а также то, как на это могут повлиять мутации в самом BTK и других киназах.
Ключевые слова: хронический лимфолейкоз, ХЛЛ, тирозинкиназа Брутона, ибрутиниб, акалабрутиниб, занубрутиниб, пиртобрутиниб, немтабрутиниб, NX-2127, NX-5948.
Общие понятия о BCR и BTK.
Разработка ингибиторов передачи сигналов B-клеточных рецепторов (BCR), особенно тех, которые ингибируют тирозинкиназу Брутона (BTK), изменила ландшафт лечения ХЛЛ за последнее десятилетие. Признание важности этого сигнального пути при ХЛЛ произошло благодаря ряду важных наблюдений за предшествующие 10–15 лет. Одним из наиболее важных результатов было то, что мутационный статус вариабельной области гена тяжелой цепи иммуноглобулина (IGHV) имел прогностическое значение у пациентов с немутированными генами IGHV (>98% гомологии с зародышевой линией), имеющих худший прогноз, чем пациенты с мутированными (≤98% гомологии с зародышевой линией) генами IGHV.
Это прогностическое различие отражается в различиях в поведении клеток ХЛЛ in vitro. Клетки немутированного ХЛЛ имеют более высокую экспрессию поверхностного иммуноглобулина (Ig; обычно IgM), что связано с сохранением способности подвергаться потоку кальция и фосфорилированию тирозина при лигировании BCR. Еще одним важным наблюдением было то, что клетки ХЛЛ демонстрируют неслучайные «стереотипированные» BCR (SAR), что соответствует влиянию на отбор со стороны антигена. Теоретически, биологическая сложность нормальных гуморальных иммунных ответов должна обеспечивать выработку огромного диапазона (>1 × 109) BCR, а это означает, что вероятность того, что у двух пациентов с ХЛЛ будут одинаковые или почти идентичные BCR, должна быть незначительной.
Несмотря на это, до трети случаев ХЛЛ имеют BCR с очень похожими последовательностями — слишком много, чтобы это можно было считать случайным явлением. Это предполагает, что антигенная стимуляция является важным компонентом патогенеза ХЛЛ, определяющим выбор неслучайных BCR, которые узнают определенные эпитопы этих антигенов. Примечательно, что BCR от случаев мутированного ХЛЛ, как полагают, обладают более высокой аффинностью связывания с ограниченным набором эпитопов, что отражает тот факт, что клон возник из B-клетки, которая претерпела соматическую гипермутацию и созревание аффинности в зародышевом центре.
Напротив, BCR от случаев немутированного ХЛЛ экспрессируют полиреактивные BCR, которые связываются с низким сродством к окружению и аутоантигенам, таким как виментин, миозин или ревматоидные факторы. Любопытно, что дальнейшие сообщения свидетельствуют о том, что сами BCR ХЛЛ могут имитировать взаимодействие с антигеном. Одним из механизмов, с помощью которого связывание внеклеточного антигена с BCR передается внутриклеточному сигнальному аппарату, является индуцирование кластеризации BCR, способствующее образованию «микросигналосом». Наблюдение того, что BCR ХЛЛ способны связываться друг с другом и группироваться в отсутствие антигена, что позволяет им передавать сигналы автономным образом, является еще одним свидетельством важности этого пути. Еще большее подтверждение этому было предоставлено исследованиями по профилированию экспрессии генов, в которых подчеркивалась передача сигналов BCR как наиболее дифференциально регулируемый путь в клетках ХЛЛ, активированных в лимфатических узлах.
Понимание молекулярной передачи сигналов BCR выявляет множество потенциальных мишеней. Несколько препаратов, ингибирующих киназы, участвующие в этом пути, прошли клинические испытания, включая ингибиторы SYK (фостаматиниб, энтосплетиниб), pan-SRC киназ (дазатиниб), PI3K (иделалисиб, IPI-145, ACP319) и BTK (ибрутиниб, спебрутиниб (CC-292) и тирабрутиниб (ONO-4059)). Несмотря на то, что все эти агенты показали эффективность в большей или меньшей степени, BTK и PI3K быстро стали предпочтительными мишенями, а ибрутиниб и иделалисиб стали исходными ведущими соединениями соответственно.
Одной из примечательных клинических особенностей, наблюдавшихся при применении всех ингибиторов передачи сигналов BCR, начиная с первых испытаний ингибитора SYK фостаматиниба, было быстрое снижение лимфаденопатии/спленомегалии, сопровождающееся лимфоцитозом. Этот феномен представляет собой перераспределение клеток ХЛЛ из вторичных лимфоидных органов в периферическую кровь, приводящее к оттоку опухолевых клеток из защитного узлового микроокружения, что наряду с прямым проапоптотическим действием лежит в основе клинической эффективности этих препаратов.
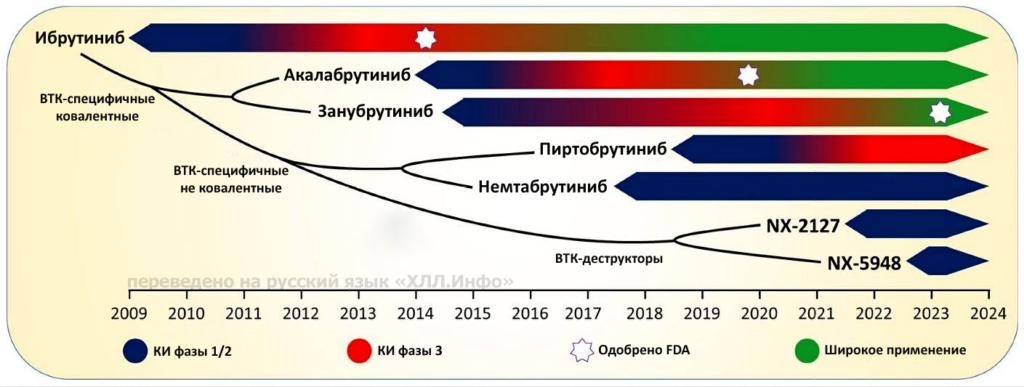
График клинических испытаний фазы 1/2 показан темно-синим цветом, клинических испытаний фазы 3 — красным, а широкое распространение — зеленым. Белая звезда указывает на момент одобрения Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA).
Ибрутиниб: первый iBTK в своём классе
Ибрутиниб (PCI-32765), был первым ингибитором BTK, прошедшим клинические испытания. Ибрутиниб представляет собой биодоступную при пероральном приеме небольшую молекулу, которая необратимо связывается с остатком цистеина (C481) в киназном домене BTK, ингибируя его ферментативную активность. BTK уже можно было считать критическим компонентом передачи сигналов BCR и, следовательно, гуморального иммунитета, благодаря наблюдениям Bruton относительно Х-сцепленной агаммаглобулинемии (XLA).
Лица с XLA имеют мутации в гене BTK (присутствующие на длинном плече Х-хромосомы) и иммунодефицит, характеризующийся отсутствием зрелых B-клеток, что приводит к тяжелому дефициту антител и рецидивирующим инфекциям. Доклинические наблюдения подтвердили важность BTK при ХЛЛ, продемонстрировав сверхэкспрессию этой киназы в лейкемических клетках по сравнению со здоровыми В-клетками, при этом ибрутиниб продемонстрировал преимущественное, хотя и умеренное, уничтожение клеток ХЛЛ in vitro.
В начальном исследовании фазы 1b/2 с участием 85 пациентов с рецидивирующим/рефрактерным ХЛЛ или ЛМЛ сравнивались две разные дозы ибрутиниба: 420 мг и 840 мг. Интересно, что общий уровень ответа был одинаковым в обеих группах – 71%, при этом непрерывная терапия в целом переносилась хорошо. Фармакокинетические оценки после лечения показали полное заполнение BTK ибрутинибом на обоих уровнях дозы, определив 420 мг один раз в день в качестве стандартной дозы при ХЛЛ/ЛМЛ. Важно отметить, что частота ответа пациентов с делециями короткого плеча хромосомы 17 (del17p) была сопоставимой и составляла 68%, что подчеркивает эффективность ибрутиниба у пациентов, у которых исторически был плохой прогноз при химиоиммунотерапии.
Эти первоначальные результаты были подтверждены тремя исследованиями RESONATE. Первое исследование RESONATE продемонстрировало значительное улучшение как выживаемости без прогрессирования (ВБП), так и общей выживаемости (ОВ) при использовании ибрутиниба по сравнению с анти-CD20-антителом офатумумаб у пациентов с рецидивирующим или рефрактерным ХЛЛ/ЛМЛ. Впоследствии это было изучено в исследовании RESONATE-2, которое также продемонстрировало значительное улучшение ВБП и ОВ при приеме ибрутиниба по сравнению с хлорамбуцилом. При медиане наблюдения 60 месяцев ВБП составила 70% для ибрутиниба по сравнению с 12% для хлорамбуцила, при этом ибрутиниб также улучшил 5-летнюю выживаемость.
Ибрутиниб также хорошо переносился: по данным недавно опубликованного последующего анализа, 42% пациентов продолжали принимать ибрутиниб в течение 8 лет. Наконец, исследование RESONATE-17 подтвердило эффективность ибрутиниба у пациентов с del17p, при этом 75% пациентов остались живы в течение 2-х лет, что является значительным улучшением по сравнению с историческим контролем. Хотя эти первоначальные исследования можно было подвергнуть критике за сравнение ибрутиниба с относительно неэффективной монотерапией, превосходство ибрутиниба было подтверждено дальнейшими исследованиями по сравнению с ИХТ. Например, исследование ECOG-ACRIN продемонстрировало улучшение ВБП и ОВ при применении ибрутиниба + ритуксимаба по сравнению с флударабином, циклофосфамидом и ритуксимабом (FCR).
Примечательно, что анализ подгрупп показал, что преимущество выживаемости выше у пациентов с немутированными генами IGHV, и это открытие было повторено в других исследованиях, логически предполагая, что ингибирование BTK более эффективно в тех случаях, когда клетки ХЛЛ имеют более высокую способность передачи сигналов BCR.
Первоначальные исследования также продемонстрировали эффективность ингибитора PI3K иделалисиба для лечения ХЛЛ. В рандомизированном исследовании фазы 3 сравнивали иделалисиб + ритуксимаб с монотерапией ритуксимабом при рецидивирующем ХЛЛ, показав улучшение ВБП и ОВ в группе иделалисиба. Хотя это и привело к одобрению иделалисиба для лечения ХЛЛ, при дальнейшем наблюдении стало очевидно, что этот препарат увеличивает частоту возникновения ряда иммунозависимых и инфекционных побочных эффектов, включая диарею и колит, гепатит, реактивацию ЦМВ и пневмонии.
Более высокая частота нежелательных явлений также наблюдалась при применении другого ингибитора PI3K дувелисиба, что указывает на классовый эффект этих препаратов. Однако эффективность комбинации иделалисиб + ритуксимаб означает, что она остается вариантом для некоторых пациентов с ХЛЛ, особенно для тех, кто не подходит или невосприимчив к лечению на основе ингибиторов BTK и венетоклакса. Несмотря на то, что ибрутиниб демонстрирует лучший профиль безопасности, чем ИХТ (FCR), он не лишен побочных эффектов. К частым нежелательным явлениям относятся диарея, кашель, инфекции и миалгии, а еще одной частой и иногда серьезной проблемой является кровотечение.
Одной из особых областей, вызывающих обеспокоенность в отношении ибрутиниба, являются его сердечно-сосудистые эффекты: гипертония, фибрилляция предсердий, желудочковая аритмия и внезапная сердечная смерть. Критической особенностью является то, что ибрутиниб, являясь эффективным iBTK, также ингибирует и широкий спектр других киназ, таких как индуцируемая интерлейкином-2 киназа Т-клеток и тирозинкиназа рецептора эпидермального фактора роста. Примечательно, что именно ингибирование ибрутинибом другой киназы, C-концевой киназы SRC, считается ответственным за повышенный риск фибрилляции предсердий, наблюдаемый при приеме этого препарата. Поскольку пациентам необходимо будет принимать ингибитор BTK непрерывно в течение длительного времени, чтобы поддерживать контроль над ХЛЛ, существовало веское обоснование для разработки более высокоспецифичных ингибиторов BTK.
Акалабрутиниб и Занубрутиниб: II поколение iBTK
Появление ингибиторов BTK второго поколения — акалабрутиниба и занубрутиниба — предоставило дополнительные возможности в лечении первичного и рецидивирующего ХЛЛ. Акалабрутиниб (в дозе 100 мг два раза в день) представляет собой высокоселективный необратимый ковалентный iBTK, лицензированный в качестве монотерапии при рецидивирующем ХЛЛ после исследования ASCEND, которое продемонстрировало его превосходство над выбором исследователя либо иделалисиб-ритуксимаб, либо бендамустин-ритуксимаб.
Акалабрутиниб
Акалабрутиниб в настоящее время также одобрен для применения в сочетании с моноклональным антителом против CD20 обинутузумабом в первой линии после исследования ELEVATE-TN . Как монотерапия акалабрутинибом, так и комбинация акалабрутиниб-обинутузумаб показали существенное, превосходящее 5-летнее преимущество ВБП по сравнению с хлорамбуцилом-обинутузумабом. Добавление обинутузумаба в этом исследовании обеспечивает улучшение 5-летней ВБП на 12% по сравнению с монотерапией акалабрутинибом. Примечательно, что польза наблюдалась только у пациентов с интактным TP53, особенно у пациентов с немутированным ХЛЛ, что повторяет более ранние наблюдения с ибрутинибом. Пациенты с мутациями в TP53 или с поломкой del17p также достигли длительного контроля заболевания при лечении на основе акалабрутиниба с 4-летней ВБП 76% и 75% соответственно для монотерапии акалабрутинибом и акалабрутинибом-обинутузумабом. Пациенты, принимавшие акалабрутиниб в исследовании ASCEND, получили эквивалентную ВБП независимо от того, мутировал TP53/del17p или нет.
В открытом рандомизированном контролируемом исследовании ELEVATE-RR акалабрутиниб напрямую сравнивался с ибрутинибом у пациентов с рецидивирующим и/или рефрактерным ХЛЛ и по крайней мере с одним генетическим отклонением высокого риска (мутация del17p/ TP53 или делеция 11q). Исследование было разработано для оценки не меньшей эффективности ВБП, а также для оценки иерархического превосходства различий в токсичности между двумя BTK. При медиане наблюдения 40,9 месяцев не было различий в ВБП между двумя препаратами, но у пациентов, получавших акалабрутиниб, наблюдалось значительное улучшение профиля безопасности.
Нежелательные явления со стороны сердца любой степени тяжести и несердечные нежелательные явления (диарея, миалгия/артралгия, кровотечение) уменьшались при приеме акалабрутиниба, причем меньшее количество нежелательных явлений приводило к прекращению лечения. В свете этого, улучшенная специфичность акалабрутиниба в отношении БТК, по-видимому, приводит к улучшению профиля безопасности по сравнению с ибрутинибом, сохраняя при этом сопоставимую эффективность. Примечательно, что акалабрутиниб также продемонстрировал эффективность и безопасность у пациентов с ХЛЛ с непереносимостью ибрутиниба и является ценным вариантом лечения в этой конкретной группе пациентов.
Занубрутиниб
Занубрутиниб (в дозе 160 мг два раза в день) — еще один необратимый ковалентный iBTK второго поколения, одобренный в качестве монотерапии как для лечения первичного, так и для рецидивирующего ХЛЛ по результатам исследования SEQUOIA и исследования ALPINE соответственно. Занубрутиниб был разработан для обеспечения лучшей специфичности BTK, чем ибрутиниб, и более устойчивого присутствия BTK с охватом воздействия выше полумаксимальной ингибирующей концентрации (IC50) в течение 24-часового периода дозирования. Исследование SEQUOIA продемонстрировало улучшенную ВБП при непрерывном применении занубрутиниба по сравнению с бендамустином/ритуксимабом фиксированной продолжительности у пациентов на первой линии без del17p. При медиане наблюдения 26,2 месяца медиана ВБП не была достигнута ни в одной группе, но 24-месячная ВБП составила 69,5% и 85,5% соответственно. Преимущество снова было отмечено в первую очередь у пациентов с немутированным ХЛЛ. Сто десять пациентов с мутацией del17p/TP53 были включены в отдельную открытую нерандомизированную группу II фазы исследования SEQUOIA, получавших монотерапию занубрутинибом до прогрессирования заболевания. При медиане наблюдения 30,5 месяцев общая частота ответа составила 90%, расчетная 24-месячная ВБП составила 88,9%, а расчетная 24-месячная общая выживаемость составила 93,6%.
Недавно опубликованное исследование ALPINE напрямую сравнивало монотерапию занубрутинибом с монотерапией ибрутинибом в крупном открытом рандомизированном исследовании фазы 3 с ЧОО (исключая частичный ответ с лимфоцитозом) в качестве первичной конечной точки, с ВБП и ключевыми вторичными конечными точками безопасности. Популяция была шире, чем в ELEVATE-TN, в нее были включены все пациенты с рецидивом ХЛЛ, не принимавшие iBTK, и представляла собой когорту пациентов с относительно низким риском (среднее количество предыдущих линий 1, мутация TP53/делеция 17p 23%). При средней продолжительности наблюдения 29,6 месяцев занубрутиниб продемонстрировал более высокую ВБП по сравнению с ибрутинибом. Эта разница была также отмечена в подгруппе пациентов с ХЛЛ с мутацией TP53 /del17p. Важными данными в пользу занубрутиниба были показатели прекращения лечения по причинам, не связанным с прогрессированием заболевания, внезапной сердечной смертью и частотой фибрилляции предсердий. Профиль токсичности двух агентов по другим параметрам, таким как гипертония, инфекция, кровотечение и цитопения, был сходным. Занубрутиниб также недавно продемонстрировал безопасность и эффективность у 67 пациентов, имевших непереносимость ибрутиниба и акалабрутиниба.
По результатам всех исследований, кажется разумным рекомендовать эти iBTK второго поколения с повышенной специфичностью в отношении BTK (по сравнению с ибрутинибом) из-за улучшенного профиля безопасности акалабрутиниба и продемонстрированной улучшенной эффективности и безопасности занубрутиниба. Неизвестно, превосходит ли занубрутиниб по эффективности акалабрутиниб, и пока таких КИ не запланировано. В исследованиях ALPINE и ELEVATE-RR изучались разные группы риска пациентов, расположенные в разных географических регионах и в разные эпохи лечения, поэтому перекрестное сравнение этих исследований невозможно. Однако теперь, когда клинические преимущества воздействия на BTK с улучшенной специфичностью доказаны, следующим шагом в эволюционном процессе ингибирования этой киназы при ХЛЛ является проверка того, может ли изменение способа связывания лекарств с BTK еще больше повысить «пригодность» этих агентов для лечения ХЛЛ.
Пиртобрутиниб и Немтабрутиниб: нековалентные iBTK
Хотя ковалентные BTK значительно улучшают результаты лечения пациентов с ХЛЛ/ЛМЛ, они не являются излечивающими. Длительное непрерывное применение может быть связано с побочными эффектами, которые пациенты тяжело переносят, а также приводит к резистентности из-за развития мутаций. В настоящее время описано несколько мутаций резистентности, включая мутацию цистеин-серин в BTK в сайте связывания ибрутиниба (мутация C481S) или мутации усиления функции в нижестоящей киназе PLC-γ2 (мутации R665W и L845F). С учетом этих особенностей были разработаны нековалентные iBTK, способные преодолеть наиболее распространенный механизм резистентности, связанный с использованием ковалентных iBTK. Нековалентное связывание с BTK не зависит от сайта связывания C481, поэтому можно разработать лекарства, которые ингибируют BTK дикого типа и мутантный C481 с эквивалентной эффективностью. Двумя препаратами, которые наиболее продвинуты в клинической разработке, являются пиртобрутиниб и немтабрутиниб.
Пиртобрутиниб
Пиртобрутиниб (формально LOXO-305) представляет собой высокоселективный, первый в своем классе нековалентный (обратимый) ингибитор BTK, безопасность и эффективность которого оценена у пациентов с ХЛЛ/ЛМЛ, ранее получавших ковалентный iBTK в первой фазе 1–2 исследования BRUIN . Пиртобрутиниб имеет благоприятный фармакокинетический профиль с высокой биодоступностью при пероральном приеме и длительным периодом полувыведения (около 19 часов). Это позволяет вводить дозу один раз в день при устойчивых уровнях лекарственного средства в плазме в течение 24-часового интервала дозирования, независимо от собственной скорости оборота BTK.
Профиль селективности пиртобрутиниба может минимизировать нецелевое ингибирование и связанную с ним токсичность. Самая последняя информация о пациентах с ХЛЛ в исследовании BRUIN предоставила данные о выживаемости и токсичности у 247 пациентов с ХЛЛ/ЛМЛ, предварительно получавших iBTK, со средним периодом наблюдения 19,4 месяца. ЧОО для всех пациентов составила 82,2%, если учитывать частичный ответ с лимфоцитозом. Сходные показатели ответа наблюдались у пациентов с двойным воздействием (ковалентные iBTK и BCL2i), у пациентов с аберрантным статусом TP53, у пациентов с пентадным воздействием (анти-CD20, ХТ, ковалентные iBTK, BCL2i, Pi3Ki) и пациентов с мутацией C481.
Возможно, неудивительно, что частота ответа у пациентов с нижестоящими мутациями в PLCγ2 была ниже (ЧОО 55,6%). Медиана ВБП для всей группы составила 19,6 месяцев. Наиболее распространенными нежелательными явлениями, возникшими в результате лечения (TEAE) всех степеней у всех 773 пациентов с B-клеточными злокачественными новообразованиями в BRUIN, получавших пиртобрутиниб, были утомляемость (29%), нейтропения (24%) и диарея (24%). Частота событий, связанных с iBTK и представляющих особый интерес, была низкой, включая гипертонию (9,2%), фибрилляцию/трепетание предсердий (2,8%), незначительное кровотечение и большое кровотечение (2,2%). Примечательно, что только 3% пациентов во всем исследовании BRUIN прекратили прием пиртобрутиниба из-за побочных эффектов, связанных с лечением. Пиртобрутиниб также продемонстрировал отличный профиль безопасности у 123 пациентов с В-клеточными злокачественными новообразованиями, у которых ранее была остановлена терапия ковалентными iBTK (ибрутиниб (n = 118), акалабрутиниб (n = 29) или занубрутиниб (n = 6)) из-за непереносимости. В целом, 7% из этих 123 пациентов впоследствии прекратили прием пиртобрутиниба из-за нежелательных явлений (только четверо прекратили лечение по причинам, связанным с пиртобрутинибом), а рецидивы нежелательных явлений, как правило, были меньшей степени.
В настоящее время проводится ряд рандомизированных исследований, чтобы закрепить его роль у пациентов, подвергшихся воздействию ковалентного iBTK, и потенциально продвинуть препарат дальше по пути лечения, например, исследование BRUIN-322 , в котором сравнивается венетоклакс-ритуксимаб с комбинацией венетоклакс-ритуксимаб–пиртобрутиниб у пациентов, ранее не получавших iBTK, и пациентов, подвергшихся их воздействию.
Немтабрутиниб
Немтабрутиниб (МК-1026, ранее ARQ-531) — еще один нековалентный iBTK, находящийся на ранней стадии разработки в фазе I-II 1/2 исследования BELLWAVE-001 . Недавно были представлены обновленные данные об эффективности для 57 пациентов с ХЛЛ, получавших немтабрутиниб в дозе 65 мг один раз в день, и безопасности для всех 112 пациентов с В-клеточными злокачественными новообразованиями, получавших лечение в дозе 65 мг. Среднее количество предшествующих линий лечения составляло 4 (1–18), при этом 95% участников ранее получали ковалентные iBTK, а 42% также получали ингибитор BCL2. При относительно коротком медиане наблюдения (8,1 месяца) ЧОО составила 56%, а расчетная медиана продолжительности ответа составила 24,4 месяца. 73% пациентов испытали нежелательные явления, связанные с лечением, любой степени тяжести. Наиболее распространенными НЯ (≥10%) были: дисгевзия (нарушения вкуса) (21%), нейтропения (20%), утомляемость (13%), тошнота и тромбоцитопения (по 12%), а также диарея и гипертония (по 10%). Прекращение лечения, связанное с лечением, произошло у 15 пациентов (13%), что несколько выше, чем у пациентов, принимавших пиртобрутиниб в исследовании BRUIN (2,6%). Немтабрутиниб менее селективен, чем пиртобрутиниб, и для понимания будущей роли этого многообещающего препарата необходимы дальнейшее наблюдение и больший размер выборки.
Деструкторы BTK: NX-2127 и NX-5948
Другим подходом к нацеливанию на BTK, который может оказаться важным дополнением к арсеналу препаратов от ХЛЛ, является стратегия деструкции (деградации) тирозинкиназы Брутона. В отличие от обсуждавшихся выше агентов, которые ингибируют функцию BTK, «деструкторы BTK» по существу удаляют белок BTK из клетки. Убиквитин-зависимый протеолиз является основным путем, который разрушает внутриклеточные белки как часть нормальных процессов клеточной деятельности. В этом пути белки подвергаются деградации протеасомой путем переноса молекул убиквитина на интересующий белок (в данном случае BTK) за счет совместного действия ферментов, активирующих убиквитин, ферментов, конъюгирующих убиквитин, и убиквитин-белкового белка E3-лигазы.
Первые подходы использовали существующий препарат (например, ингибитор ангиогенеза овалицин), присоединенный к коротким фосфопептидам, которые могли распознаваться одной из этих убиквитин-белковых лигаз Е3. Большим достижением стало открытие того, что мишенью талидомида и его аналогов леналидомида и помалидомида, широко используемых для лечения множественной миеломы, была другая E3-убиквитинлигаза, цереблон. Эти агенты модулируют цереблон, нацеливаясь на цинковые пальцы 1 семейства IKAROS (IKZF1) и IKZF3 для деградации, что приводит к их иммуномодулирующей и противораковой активности. В настоящее время разрабатываются несколько деструкторов BTK, в том числе NX-2127 и NX-5948, которые сейчас вступили в раннюю фазу клинических испытаний. Примечательно, что NX-2127 нацелен как на BTK, так и на IKZF3, тогда как NX-5948 просто выборочно разрушает BTK.
Оба препарата в настоящее время находятся в фазе 1 исследований, где NX-2127 уже демонстрирует клинические ответы у пациентов с ХЛЛ с большим количеством предшествующих линий терапии (в среднем 6 линий), включая пациентов с мутациями BTK, резистентными как к ковалентным, так и к нековалентным iBTK. Способность этих препаратов потенциально преодолевать мутации резистентности, возникающие при лечении ингибиторами BTK, может означать, что они образуют важный компонент будущих алгоритмов лечения ХЛЛ.
При подготовке этой статьи использованы материалы:
1. Eyre TA, Riches JC. The Evolution of Therapies Targeting Bruton Tyrosine Kinase for the Treatment of Chronic Lymphocytic Leukaemia: Future Perspectives. Cancers (Basel). 2023 May 3;15(9):2596. doi: 10.3390/cancers15092596. PMID: 37174062; PMCID: PMC10177608.