За последние десятилетия, изучение репертуара генов IGHV у пациентов с ХЛЛ показало его значительное сужение. Было обнаружено, что в ряде неродственных случаев ХЛЛ, как с мутированными, так и с немутированными генами IGHV, часто встречались практически идентичные аминокислотные последовательности антигенсвязывающих участков (область CDR3), позже названные стереотипными антигенными рецепторами.
Что такое SAR?
Стереотипные Антигенные Рецепторы (САР) или Stereotyped Antigen Receptors (SAR) — рецепторы, у которых совпадает набор использованных V‑, D‑ и J‑генов.
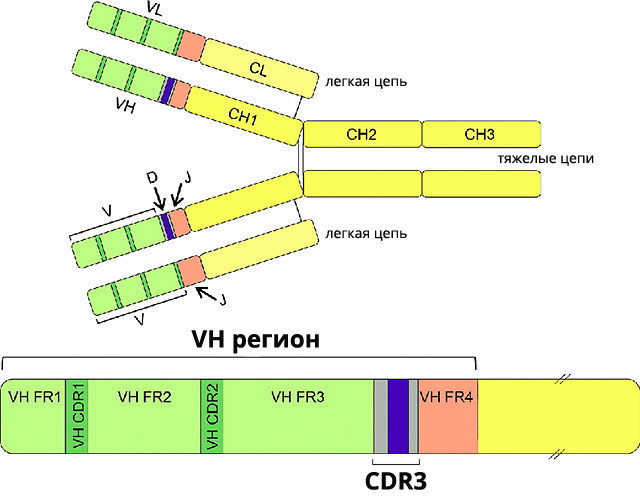
Молекулы иммуноглобулина являются основным компонентом В-клеточного рецепторного комплекса. Перестроенные гены иммуноглобулинов присутствуют в каждой В-клетке с самых ранних стадий развития, их нуклеотидные последовательности являются уникальными.
Когда В-клетка превращается в клетку ХЛЛ, нуклеотидная последовательность генов IGHV становится уникальным маркером для всего опухолевого клона, оставаясь стабильной и неизменной по мере развития заболевания, в отличие от других генетических маркеров, таких как геномные аберрации.
В процессе реаранжировки генов иммуноглобулинов принимают участие гены IGHV, IGHD и IGHJ. Объединение этих генов создает уникальную структуру 3-го комплементарного региона (CDR3) – важной части молекулы иммуноглобулина, определяющей аффинность к антигену. Учитывая количество функциональных IGHV- (50), IGHD- (около 30) и IGHJ-генов (6), вероятность получения одинаковых последовательностей CDR3 ничтожно мала, однако у 30-35% больных ХЛЛ, проживающих в разных странах, отмечено совпадение CDR3 областей, что расценивают как доказательство антигенной селекции опухолевого клона. Все случаи ХЛЛ со стереотипными CDR3 последовательностями объединяют в подгруппы, количество которых неуклонно возрастает.
Критерии стереотипности:
1) использование гена IGHV одного филогенетического клана;
2) не менее 50 % аминокислотной идентичности и 70 % сходства внутри CDR3;
3) одинаковая длина последовательности CDR3;
4) единый аминокислотный шаблон (точное местоположение аминокислот внутри CDR3).
Как определить принадлежность генов к SAR?
Чтобы определить принадлежность генов IGHV к семейству SAR, необходима полная нуклеотидная последовательность исследованных генов в формате FASTA .
Такая нуклеотидная последовательность должна быть обработана специальным программным инструментом ARResT/AssignSubsets .
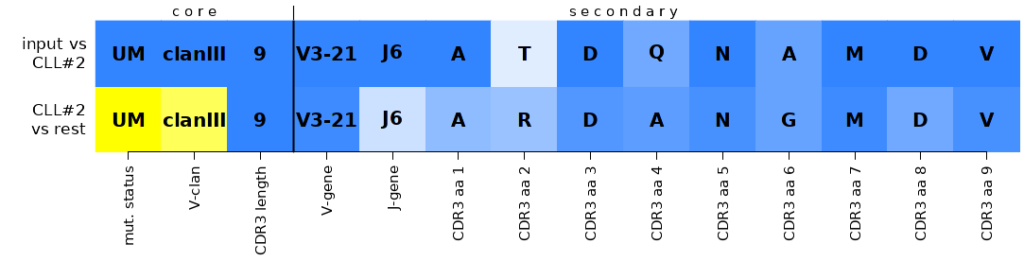
Пример последовательности принадлежащей к подгруппе CLL#2:
>eg1
gaggtgcagctggtggagtctgggggaggcctggtcaagcctggggggtccctgagactctcctgtgcagcctctggattcaccttcagtagctatagcatgaactgggtccgccaggctccagggaaggggctggagtgggtctcatccattactagtagtagtagttacacatactacgcagactcagtgaagggccgattcgccatctccagagacaacgccaagaactcactatatctgcaaatgaacagcctgagacccgaggacacggctgtgtattactgtgcgacagatcagaacgctatggacgtctggggccaagggaccacggtcaccgtctcctcaggt
Классификация основных подгрупп в Энциклопедии подгрупп SAR
Клиническая значимость SAR
Более 40% всех больных ХЛЛ можно отнести к одной из подгрупп SAR. Большинство основных SAR образованы немутированным IGHV. Аминокислотные мотивы SAR с немутированным IGHV более консервативны, по сравнению с мутированными вариантами.
Несколько независимых исследований показали, что пациенты, отнесенные к одной и той же подгруппе SAR, демонстрируют сходные биологические особенности, включая одинаковые рецидивирующие генетические поражения, профили экспрессии генов, эпигенетические модификации и т.д. Более того, стереотипия определяет подгруппы со схожей клинической картиной и исходом, что особенно иллюстрируют: подгруппа CLL#2, которая связана с агрессивным клиническим течением лимфолейкоза, независимо от мутационного статуса IGHV, и с невосприимчивостью к ИХТ, а также подгруппа CLL#8, которая демонстрирует самый высокий риск трансформации Рихтера среди всех ХЛЛ. Следовательно, информация о принадлежности пациента к подгруппе CLL может способствовать уточнению стратификации риска пациентов с ХЛЛ, по крайней мере, для определенных подмножеств.
Мутации SF3B1 очень часто выявлялись у пациентов CLL#2 — в 45% случаев. В то же время, по данным этих исследовательских групп, мутации в этом гене наблюдались значительно реже у пациентов с экспрессией нестереотипного гена IGHV3–21.
Мутации TP53, напротив, у пациентов с CLL#2 встречаются крайне редко, что было подтверждено разными исследователями. С другой стороны, делеции и мутации в генах TP53 и NOTCH1 часто выявляются у пациентов с наиболее распространенной в России подгруппой CLL#1 — 16–30%. В результате этих особенностей некоторые подгруппы SAR считаются независимыми прогностическими факторами при ХЛЛ.
В настоящее время, согласно рекомендациям Европейской исследовательской инициативы по ХЛЛ (ERIC ), о наличии CLL#2 и CLL#8 у пациента необходимо сообщать врачу. Подгруппа CLL#4 связана с очень благоприятным, индолентным течением заболевания.
Ген IGHV3-21 был первым геном IGHV, который, как было признано, отмечает подгруппу ХЛЛ с очень плохим прогнозом, хотя обычно несет конфигурацию мутированного гена IGHV. Хронический лимфолейкоз экспрессирующий IGHV3-21 имеет клиническое течение, сходное с клиническим течением немутированного ХЛЛ.
Особенностью ХЛЛ, экспрессирующих IGHV3-21, является крайне гетерогенное географическое распространение. Среди пациентов из скандинавских стран IGHV3-21 был вторым по частоте геном, экспрессировавшимся более чем в 10% случаев, и наиболее часто используемым геном в мутированном варианте, хотя и с относительно низкой (2–5%) мутационной нагрузкой. Интересно, что выживаемость скандинавских пациентов с мутированным IGHV3-21 была хуже, чем у мутированных ХЛЛ с другими генами, и была аналогична выживаемости немутированного ХЛЛ.
Сравнительно высокая частота использования гена IGHV3-21 (около 9–10%) была обнаружена также в британских и бельгийских сериях ХЛЛ. И наоборот, в сериях ХЛЛ из стран Южной Европы (т.е. Италии, Испании, Греции и Франции) частота использования гена IGHV3-21 была заметно ниже, с процентами в диапазоне от 0% до 5%. Серия ХЛЛ из США следовала тенденции, обнаруженной в когортах Южной Европы.
Экспрессия IGHV3-23 также была указана как дополнительный маркер плохого прогноза при мутированном ХЛЛ. Сообщается о промежуточном клиническом поведении IGHV3-23. Ген IGHV3-23 один из наиболее часто используемых генов IGHV при ХЛЛ, в большинстве случаев он экспрессируется в мутированном варианте ХЛЛ и постоянно отсутствует в подмножествах стереотипных BCR. Действительно, в трех крупнейших исследованиях, опубликованных на данный момент, в которых коллективно было изучено 5000 случаев ХЛЛ, ни одна из подтвержденных стереотипных подгрупп ХЛЛ не включала последовательности IGHV3-23.
Ген IGHV3-72 экспрессируется при ХЛЛ с особенно стабильным и доброкачественным клиническим течением. В нескольких исследованиях описаны группы случаев ХЛЛ с высокостабильным и вялотекущим заболеванием, которое не требовало лечения в течение 10–23 лет с момента постановки диагноза. Клинически у всех пациентов сохранялась вялая гематологическая картина со стадией на момент постановки диагноза, которая оставалась неизменной в течение периода наблюдения. Такие пациенты имели прогностические особенности, обычно связанные с доброкачественным клиническим течением ХЛЛ, включая отсутствие делеции 11q, делеции 17p и мутаций ТР53.
В подавляющем большинстве этих случаев присутствовали мутированные гены IGHV, легкие цепи иммуноглобулинов kappa и не экспрессировался CD38. Более того, среди высокостабильных пациентов этой серии было описано отсутствие рецидивирующих инфекционных эпизодов, причем это явление часто связано с нормальными уровнями сывороточного иммуноглобулина и нормальным или почти нормальным распределением субпопуляции Т-клеток.
Исследования, направленные на выявление молекулярно-биологических особенностей ХЛЛ при вялотекущем заболевании, показали, что значительная часть этих случаев экспрессирует ген IGHV3-72. Использование этого гена было значительно выше при высокостабильном ХЛЛ по сравнению со случаями ХЛЛ из опубликованных баз данных, неопухолевыми В-клетками или другими В-клеточными лимфопролиферативными заболеваниями. Более того, ХЛЛ с экспрессией IGHV3-72, принадлежат по меньшей мере к трем стереотипным подмножествам CLL, названным подмножествами #68, #13 и #30. Помимо этих молекулярных сходств, высокостабильные ХЛЛ, экспрессирующие ген IGHV3-72 , демонстрируют практически однородный иммунофенотипический профиль, характеризующийся маркерами хорошего прогноза: CD62L, CD54, CD49c и CD25, обычно в сочетании с низкой или отрицательной экспрессией маркеров, связанных с коротким периодом жизни: ZAP-70, CD38 и CD49d.
Нечастый феномен спонтанной регрессии при ХЛЛ связан с использованием генов, принадлежащих к подгруппе IGHV3, таких как IGHV3-30. Возникновение спонтанного регресса при ХЛЛ определяют как достижение клинической ремиссии заболевания при отсутствии какого-либо предшествующего лечения. Этот феномен хотя и признан с 1970-х годов, редко описывается в литературе.
В недавних отчетах описаны несколько случаев ХЛЛ со спонтанной регрессией заболевания в течение 11 лет наблюдения, в которых клон ХЛЛ все еще определялся иммунофенотипически в популяции циркулирующих лимфоцитов. Во всех этих случаях клетки ХЛЛ были отрицательными по CD38 и ZAP-70 и имели мутированный статус IGHV. Использование мутированного IGHV3-30 может повторяться в качестве маркера ХЛЛ с очень вялым клиническим течением и склонностью к спонтанной регрессии с течением времени. Это согласуется с наблюдением, что IGHV3-30 значительно преобладает у пациентов со стабильным мутированным ХЛЛ.
Классификация основных подгрупп в Энциклопедии подгрупп SAR
При подготовке этой статьи использованы следующие материалы:
1. Бидерман Б.В., Судариков А.Б. “Гены иммуноглобулинов и стереотипные антигенные рецепторы при хроническом лимфолейкозе и других лимфопролиферативных заболеваниях”. Гематология и трансфузиология. 2023;68(1):70-79.
2. Стадник Е.А., Румянцев А.М. “Роль мутационного статуса VH-генов в патогенезе и подходах к терапии хронического лимфолейкоза”. ФГБОУ ВО ПСПбГМУ им. И. П. Павлова; ФГБУ НМИЦ им. В.А. Алмазова МЗ РФ. – М.: Изд-во «Экон-Информ», 2020. – 39 с.
3. Бидерман Б.В., Ликольд Е.Б., Абдрахимова А.Р., Леонов Е.А., Хамаганова Е.Г., Судариков А.Б. “Репертуар HLA-аллелей у российских больных хроническим лимфолейкозом с неблагоприятным прогнозом”. Гематология и трансфузиология. 2020;65(3):312-320.
4. Kostas Stamatopoulos, Chrysoula Belessi, Carol Moreno, Myriam Boudjograh, Giuseppe Guida, Tatjana Smilevska, Lynda Belhoul, Stefania Stella, Niki Stavroyianni, Marta Crespo, Anastasia Hadzidimitriou, Laurent Sutton, Francesc Bosch, Nikolaos Laoutaris, Achilles Anagnostopoulos, Emili Montserrat, Athanasios Fassas, Guillaume Dighiero, Federico Caligaris-Cappio, Hélène Merle-Béral, Paolo Ghia, Frédéric Davi; “Over 20% of patients with chronic lymphocytic leukemia carry stereotyped receptors: pathogenetic implications and clinical correlations”. Blood 2007; 109 (1): 259–270.
5. Dal-Bo M, Del Giudice I, Bomben R, Capello D, Bertoni F, Forconi F, Laurenti L, Rossi D, Zucchetto A, Pozzato G, Marasca R, Efremov DG, Guarini A, Del Poeta G, Foà R, Gaidano G, Gattei V. “B-cell receptor, clinical course and prognosis in chronic lymphocytic leukaemia: the growing saga of the IGHV3 subgroup gene usage”. Br J Haematol. 2011 Apr;153(1):3-14.