Венетоклакс — высокоселективный и эффективный ингибитор В-клеточной лимфомы 2 (BCL-2), который способен восстанавливать апоптотический потенциал опухолевых клеток. При лечении ХЛЛ Венетоклакс показал замечательную эффективность как в монотерапии, так и в комбинированной терапии. По данным исследований MURANO и CLL14, комбинированная терапия Венетоклаксом с фиксированной продолжительностью и анти-CD20 моноклональными антителами в настоящее время является стандартом лечения во многих странах.
Связь между сверхэкспрессией белков BCL-2 и злокачественными новообразованиями четко определена и описана . Будучи важнейшим механизмом выживания, экспрессия BCL-2 способствует опухолевому генезу и устойчивости к терапии, позволяя опухолевым клеткам уклоняться от апоптоза.
Применение Венетоклакса
Венетоклакс применяют при терапии ХЛЛ в режимах: Венетоклакс в монорежиме, в режиме Венетоклакс + Обинутузумаб, в режиме Венетоклакс + Ибрутиниб, а также Венетоклакс + Ритуксимаб.
Описание Венетоклакса в регистре лекарственных средств России
Смотри видео о Венетоклаксе – Место ингибиторов BCL-2 в лечении ХЛЛ
Лимфоидные злокачественные новообразования часто демонстрируют сверхэкспрессию BCL-2, что делает ингибиторы BCL-2 привлекательным терапевтическим вариантом.
Венетоклакс — это первый в своем классе биодоступный пероральный миметик BH-3, разработанный методом обратного проектирования для получения соединения, высокоселективного к BCL-2, со значительно более низким сродством к BCL-W и BCL-XL, молекулам имеющим решающее значение для выживания тромбоцитов. Венетоклакс связывается с BCL-2 с высоким сродством, нарушая передачу сигналов BCL-2 внутри клетки и индуцируя TP53-независимый путь апоптоза. Он изменил парадигму лечения ХЛЛ и представляет большой интерес для других гематологических злокачественных новообразований, таких как индолентная неходжкинская лимфома, ММ и ОМЛ.
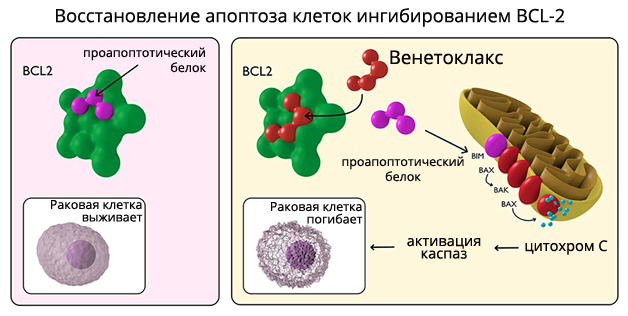
В опухолевых клетках антиапоптотический белок BCL-2 секвестрирует и блокирует функцию проапоптотических белков, содержащих только BH-3 и предотвращает апоптоз. Венетоклакс вытесняет и реактивирует проапоптотические белки, связанные с BH3-связывающей бороздкой BCL-2. Высвобождаемые проапоптотические белки связываются с апоптотическими эффекторами ВАХ и ВАК и индуцируют пермеабилизацию внешней мембраны митохондрий. Цитохром С, высвобождаемый из митохондрий, активирует каспазы и запускает гибель опухолевых клеток.
BCL-2 сверхэкспрессируется в клетках ХЛЛ, что позволяет им уклоняться от апоптоза и накапливаться in vivo, что делает ХЛЛ идеальным заболеванием для терапии Венетоклаксом. Благодаря своей благоприятной эффективности и переносимому профилю токсичности Венетоклакс стал стандартом лечения вновь выявленного ХЛЛ и рецидивирующего рефрактерного ХЛЛ, демонстрируя глубокие и стойкие ответы независимо от неблагоприятных прогностических особенностей, таких как делеция 17p.
Монотерапия Венетоклаксом
Первое исследование монотерапии Венетоклаксом с участием человека при рецидивирующем и рефрактерном ХЛЛ было дополнено пациентами с высоким процентом (89%) плохих клинических и/или генетических прогностических особенностей. Несмотря на это, исследование продемонстрировало многообещающую эффективность дозы Венетоклакса 400 мг с общей частотой ответа 79%, полным ответом 20%, неопределяемой минимальной остаточной болезнью МОБ- 15% и 15-месячной выживаемостью без прогрессирования 69%. Это было первое сообщение о МОБ-негативности среди пациентов с рецидивирующим и рефрактерным ХЛЛ, получавших новые препараты. К сожалению, на этапе подбора дозы первого исследования на людях у трех пациентов развился клинический синдром лизиса опухоли (СЛО).
Внедрение ряда мер по снижению СЛО, включая постепенное титрование дозы, гидратацию, средства, снижающие уровень мочевой кислоты, и постоянный мониторинг, значительно снизили риск этого осложнения. Последующие данные в когорте из 158 пациентов, большинство (97%) с рефрактерным ХЛЛ и делецией 17p, установили многообещающую переносимость и стойкие ответы, включая общую частоту ответа 77%, МОБ- в периферической крови 30% и ВБП 50%, при расчетной 24-месячной длительности лечения.
Промежуточный анализ исследования Венетоклакса фазы 2 у пациентов с ХЛЛ, заболевание которых прогрессировало после терапии Ибрутинибом, показал устойчивую активность с частотой общего ответа 65% при 14-месячном наблюдении, что указывает на терапевтический потенциал венетоклакса в этих условиях.
Аналогичным образом, исследование фазы 2 с участием 36 пациентов с рефрактерным ХЛЛ с прогрессированием заболевания во время или после терапии иделалисибом показало многообещающую эффективность с частотой общего ответа 67% и расчетной 12-месячной ВБП 79%.
Ретроспективные данные 683 пациентов с ХЛЛ, получавших ибрутиниб, иделалисиб или венетоклакс после начального прогрессирования на терапии ибрутинибом или иделалисибом, продемонстрировали незначительно лучшие результаты у пациентов, получавших венетоклакс (частотой общего ответа 79%), по сравнению с иделалисибом (частотой общего ответа 46%). Кроме того, использование ингибиторов ВТК после прогрессирования ХЛЛ на Венетоклаксе является безопасным и эффективным.
Комбинированная терапия
Исследование MURANO продемонстрировало превосходную эффективность комбинации Венетоклакс + Ритуксимаб (VenR) по сравнению с Бендамустин + Ритуксимаб (BR), включая более высокие показатели МОБ- при оценке ответа через 9 месяцев (62% против 13%). Хотя нейтропения выше III степени чаще встречалась в группе VenR (57,7% против 38,8%), частота фебрильной нейтропении (3,6% против 9,6%) и инфекций (17,5% против 21,8%) была ниже, чем в группе BR.
СЛО ≥III степени наблюдался у 3% пациентов в группе VenR. В ходе 5-летнего последующего анализа было сообщено об устойчивом преимуществе VenR по ВБП и общей выживаемости по сравнению с BR (ВБП 52,6 мес против 17 мес и 82% против 61% соответственно). МОБ-негативность была предиктором более продолжительной ВБП и, скорее всего, лежит в основе превосходной эффективности режима VenR. Однако традиционные генетические особенности высокого риска, включая немутированный IGVH, делецию 17p и комплексный кариотип, продолжают приводить к худшему долгосрочному результату, неся более высокий риск конверсии МОБ и рецидива.
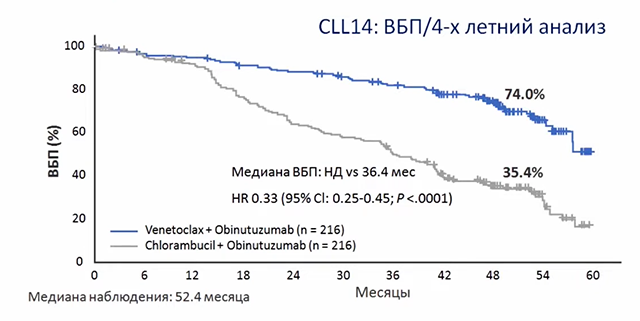
В исследовании CLL14 было установлено, что комбинация Венетоклакса и Обинутузумаба является вариантом лечения с фиксированной продолжительностью для пациентов с ранее не леченым ХЛЛ с сопутствующими заболеваниями. При медиане наблюдения 39,6 месяцев, когда все пациенты не принимали терапию в течение как минимум 2 лет, группа Венетоклакс + Обинутузумаб имела значительно более длительную ВБП, чем группа Хлорамбуцил + Обинутузумаб. Медиана ВБП не была достигнута в первой группе и составила 35,6 месяцев во второй группе. Наиболее частым нежелательным явлением степени ≥3 была нейтропения (53%). Это сделало доступным эффективный вариант лечения без химиотерапии для пациентов с сопутствующими заболеваниями и генетикой высокого риска.
На основании синергизма, наблюдаемого в доклинических моделях, другой стратегией является комбинация Венетоклакса с ингибиторами БТК, которые назначаются в виде монотерапии в течение первых 2–3 циклов, чтобы обеспечить мобилизацию клеток ХЛЛ из лимфатических узлов и снижение опухолевой нагрузки. Венетоклакс впоследствии добавляется в качестве терапии фиксированной продолжительности или прекращения лечения под контролем МОБ.
Было показано, что тройная комбинированная терапия Венетоклакса с ингибиторами ВТК и моноклональными антителами против CD20 хорошо переносится и приводит к глубоким ремиссиям в начальной стадии и в условиях рецидива. Исследование фазы 2 Венетоклакса сочеталось с Ибрутинибом и Обинутузумабом в общей сложности 14 циклов у 50 пациентов с ХЛЛ. Через два месяца после завершения терапии частота общего ответа составила около 85%. Медиана выживаемости без прогрессирования не была достигнута через 24 месяца.
Аналогичным образом, тройная комбинация венетоклакса фиксированной продолжительности с акалабрутинибом и обинутузумабом (AVO) или ритуксимабом (AVR) у пациентов с TN ( n = 12) или RR CLL ( n = 12) соответственно продемонстрировала высокие показатели в обеих группах, все из которых достигли МОБ-. Комбинация триплетной терапии AVO также была активна в исследовании фазы 2 у 44 пациентов с нелеченым CLL, включая 40% с мутацией TP53. Большинство (78%) достигли МОБ- в костном мозге после 15 месяцев терапии фиксированной продолжительности. Комбинации AVO и AVR показали переносимые профили токсичности, соответствующие отдельным препаратам.
Добавление Венетоклакса к Занубрутинибу и Обинутузумабу изучалось в исследовании BOVen с использованием стратегии отмены, направленной на МОБ, после завершения минимум 10 и максимум 24 циклов терапии. При среднем периоде наблюдения 14 месяцев наблюдались высокие показатели МОБ- в крови (92%) и костном мозге (84%), что привело к 77% показателям прекращения лечения при заранее определенных конечных точках МОБ. Триплетная комбинированная терапия хорошо переносилась с низкой частотой нежелательных явлений ≥3 степени (5%), чаще всего нейтропении.
При подготовке этой статьи использованы материалы:
1. Lasica M, Anderson MA. Review of Venetoclax in CLL, AML and Multiple Myeloma. J Pers Med. 2021 May 24;11(6):463. doi: 10.3390/jpm11060463. PMID: 34073976; PMCID: PMC8225137.
2. Jana Mihalyova, Tomas Jelinek, Katerina Growkova, Matous Hrdinka, Michal Simicek, Roman Hajek, “Venetoclax: A new wave in hematooncology”, Experimental Hematology, Volume 61, 2018, Pages 10-25, ISSN 0301-472X, https://doi.org/10.1016/j.exphem.2018.02.002.