Кроветворная ткань в процессе эмбриогенеза располагается последовательно в желточном мешке, печени, селезенке и на поздних его стадиях мигрирует в костный мозг.
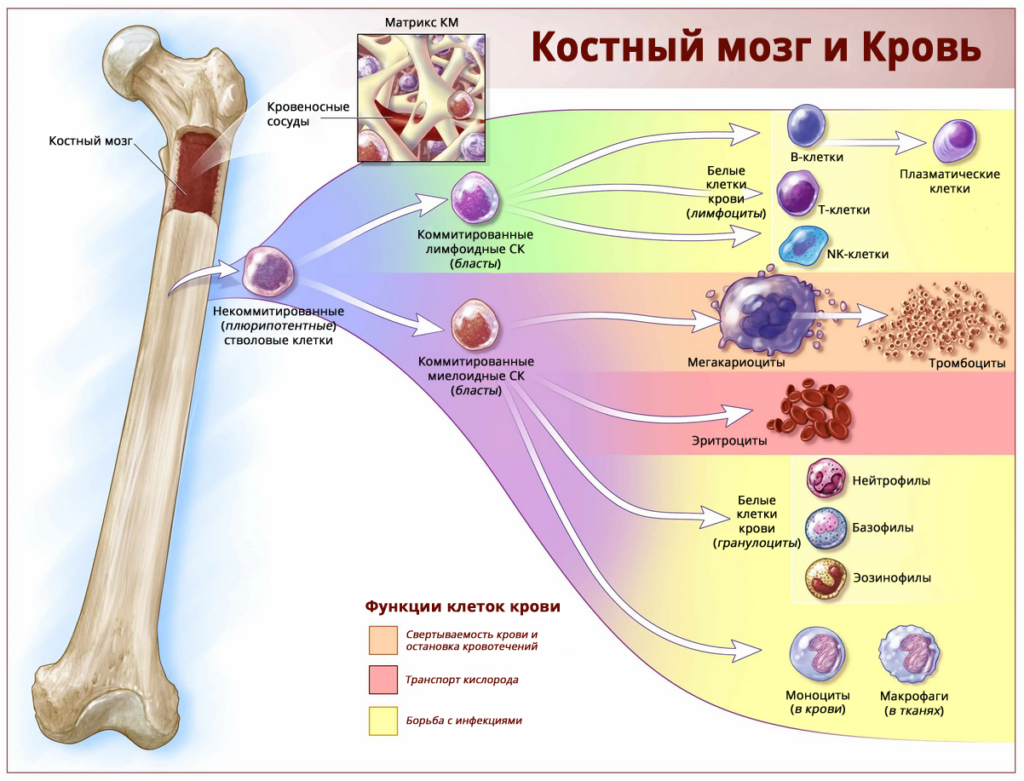
Костный мозг — основной кроветворный орган, у детей он распространен по всем костям скелета. С возрастом относительное его количество уменьшается, и у взрослых людей костный мозг обнаруживается в губчатых костях и эпифизах трубчатых костей. Основная его масса находится в тазовых костях, меньше — в черепе.
Гистологически костный мозг состоит из стромы и кроветворной ткани. В костном мозге проходят основные этапы кроветворения (гемопоэза). Состав костного мозга представлен стволовыми клетками разной степени дифференцировки и направленности развития и стромы. Клетки стромы являются адипоцитами, фибробластами, остеобластами, эндотелиальными клетками и макрофагами. Они функционируют во внеклеточном матриксе, который состоит из коллагена, молекул гликопротеидов (фибронектина и тромбоспондина) и гликозаминогликанов (гиалуроновой кислоты и дериватов хондроитина). Только микроокружение стромы костного мозга, выработка ее клетками различных регуляторных фактов обеспечивают сохранение жизнеспособности и адекватного существования стволовых клеток.
Самыми ранними кроветворными клетками являются плюрипотентные стволовые клетки – мезенхимные стволовые клетки, которые дают начало клеткам стромы, и гемопоэтические стволовые клетки. На самых ранних этапах из плюрипотентной стволовой кроветворной (гемопоэтической) клетки образуются предшественники миелопоэза и лимфопоэза (полипотентные стволовые клетки). Предшественники миелопоэза, в свою очередь, дают начало эритроидному, тромбоцитарному, гранулоцитарно-моноцитарному росткам кроветворения (унипотентные стволовые клетки).
Предшественники лимфопоэза образуют отдельные линии В-, Т- и NK-клеточных направлений дифференцировки. В результате функционирования гемопоэза в кровь постоянно поступают молодые эритроциты, тромбоциты, лейкоциты (гранулоциты, моноциты, лимфоциты). Эритроциты, тромбоциты всю свою дальнейшую жизнь остаются в периферическом русле; гранулоциты и моноциты проникают через сосудистую стенку в ткани; лимфоциты, приобретая специфические маркеры адгезии, локализуются в органах иммунной системы для дальнейшего обучения — пролиферации и дифференцировки под воздействием собственных (Т-лимфоциты) или чужеродных (В-лимфоциты) антигенов.
Миелопоэз
Миелопоэз — процесс образования эритроцитов, тромбоцитов, гранулоцитов и моноцитов полностью осуществляется в костном мозге и заканчивается выходом в периферическую кровь зрелых клеток. Нейтрофилы попадают в кровоток на стадии палочкоядерных или сегментоядерных нейтрофилов, эозинофилов, базофилов; эритроциты могут циркулировать со стадии безъядерных форм — ретикулоцитов и собственно эритроцитов; тромбоциты отшнуровываются от мегакариоцитов и выходят в кровь в сосудах — синусах костного мозга. В зависимости от направления дифференцировки в миелопоэзе выделяют эритропоэз, тромбоцитопоэз, гранулоцитопоэз и моноцитопоэз.
Эритропоэз
Эритропоэз – процесс непрерывного клеточного развития от полипотентной стволовой клетки через ЭПО-чувствительную клетку и эритробласты до зрелых эритроцитов. Все этапы эритропоэза происходят в костном мозге. Процесс созревания эритробластов осуществляется в костномозговых эритробластических островках, состоящих из одного или двух макрофагов (сидерофагов), которые содержат железо и окружены эритробластами на различных стадиях созревания.
Через сидерофаги эритробластических островков в эритропоэтические клетки поступают вещества, необходимые для синтеза гемоглобина. Способность к образованию гемоглобина связана с наличием на мембране рецепторов трансферрина (CD71), которые максимально представлены на поверхности эритробластов на всех стадиях их созревания. Непосредственным предшественником эритроцитов является унипотентная стволовая клетка, которая для своей пролиферации и дифференцировки до зрелых эритроцитов нуждается в эритропоэтине (ЭПО), и поэтому она называется эритропоэтин-чувствительной стволовой клеткой.
Весь путь от ЭПО-чувствительной стволовой клетки до зрелого эритроцита составляет приблизительно 10–15 дней и зависит от нескольких регуляторных факторов. Этап созревания до первой морфологически идентифицируемой клетки эритроидного ряда занимает 3–5 дней. Он представляет собой последовательный переход от бурстобразующей единицы эритропоэза (БОЕ-Э) через колониеобразующую единицу (КОЕ-Э) до проэритробласта.
Морфологические особенности ЭПО-чувствительных стволовых клеток, так же как и полипотентной стволовой клетки, непостоянны: вне митотического цикла они напоминают лимфоциты, а в пролиферирующем состоянии — бластные клетки.
Клетки-предшественницы эритроидного ряда обладают очень высокой пролиферативной активностью: за сутки в организме взрослого человека образуется до 200 млрд эритроцитов. Образование эритроцитов осуществляется посредством последовательных стадий созревания и деления эритрокариоцитов. На стадии эритробластов эритрокариоциты активно синтезируют гемоглобин, при достижении определенной концентрации которого происходит следующий этап деления и созревания. При этом размеры клеток уменьшаются, увеличивается содержание гемоглобина, исчезает ядро. Таким образом, из одного проэритробласта образуется до 32–64 эритроцитов.
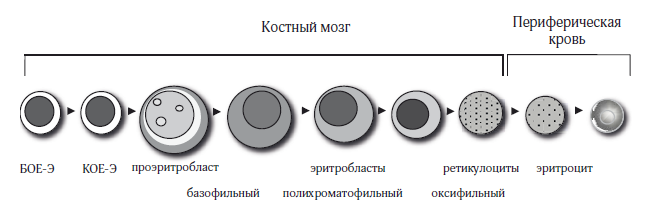
Регуляция пролиферации и дифференциации эритропоэтических клеток-предшественниц осуществляется в основном дистанционно: гликопротеидом — ЭПО. Чувствительность клеток эритроидного ряда к ЭПО различна и зависит от стадии дифференцировки, которая регулируется концентрацией на мембране рецептора ЭПО; его обнаруживают, начиная с БОЕ-Э и заканчивая полихроматофильным или оксифильным эритробластом. Основным местом синтеза ЭПО являются почки (висцеральные клетки клубочковых футляров). Регулятором продукции ЭПО служит напряжение кислорода в тканях. При развитии гипоксии в почках увеличивается синтез фактора, индуцированного гипоксией (HIF), не обладающего непосредственной эритропоэтической активностью. HIF считается основным транскрипционным активатором эритропоэза, который стимулирует выработку ЭПО.
Эритрон — совокупность морфологически идентифицируемых клеток эритроидного ростка костного мозга и периферической крови. Он представлен четырьмя категориями клеток:
1) ядросодержащие клетки КМ (эритробласт, проэритробласт, базофильный, полихроматофильный, оксифильный эритробласты (нормобласты), которые составляют до 20–25 % всех кариоцитов КМ;
2) ретикулоциты, находящиеся на стадии развития в костном мозге;
3) ретикулоциты, вышедшие в периферическую кровь;
4) эритроциты.
Тромбоцитопоэз
Первой морфологически идентифицируемой клеткой тромбоцитарного ростка кроветворения является мегакариобласт, он путем неполного деления образует гигантские многоядерные клетки мегакариоциты. В процессе их созревания параллельно увеличению размеров клетки растет число ядер, которое у зрелых мегакариоцитов достигает 4–16, в цитоплазме формируются гранулы. После созревания часть мембраны и цитоплазмы мегакариоцита выпячивается в просвет синуса и с током крови происходит отшнуровка небольших частей клетки, в результате чего образуется от одной до нескольких тысяч тромбоцитов.
Регуляция тромбообразования осуществляется тромбопоэтином — гликопротеидом, вырабатываемым в основном печенью. На поверхности мегакариобластов, мегакариоцитов и тромбоцитов имеются рецепторы тромбоэтина, связываясь с которыми он стимулирует деление, рост и отшнуровку тромбоцитов. Скорость его продукции является постоянной вне зависимости от потребностей организма. Однако при уменьшении количества циркулирующих тромбоцитов (образование тромбов, кровотечение) снижается связывание тромбопоэтина с рецепторами на их мембране и увеличивается его содержание в крови, что приводит к активации тромбоцитопоэза и развитию реактивного вторичного тромбоцитоза после указанных событий.
Гранулоцитопоэз
Процесс гранулоцитопоэза начинается с коммитированного предшественника, который под влиянием ряда факторов и микроокружения дифференцируется в одном из трех направлений: нейтрофильного, эозинофильного или базофильного. Процесс образования гранулоцитов в костном мозге состоит из последовательного формирования и деления миелобласта, промиелоцита и миелоцита, которые контролируются и стимулируются колониестимулирующими факторами. На стадии промиелоцита уже становится морфологически идентифицируемым направление дальнейшей дифференцировки клетки в одном из трех направлений.
Следующими этапами, которые связаны исключительно с созреванием (деление клеток уже не происходит), являются постепенные превращения метамиелоцита в палочкоядерный, а затем сегментоядерный гранулоцит. Обычно последние стадии клеточного развития выделяются только у нейтрофилов, т. к. большое количество эозинофильных и базофильных гранул не позволяет дифференцировать степень созревания ядра клетки.
Количество гранулоцитов в костном мозге составляет в среднем 40–80 % всех кроветворных клеток, причем большинство — зрелые и созревающие формы. Большая часть гранулоцитов не покидает костный мозг, а остается в нем до своей гибели. Считается, что продукция этих клеток превышает потребности здорового организма в 5 раз. Это необходимо для возможности их быстрой мобилизации при различных инфекционных заболеваниях, что иногда может проявляться появлением в считанные часы после начала воспаления выраженного лейкоцитоза до 20 000–30 000/мкл.
Лимфопоэз
Лимфопоэз начинается с коммитированного лимфоидного предшественника, затем разделяется на В- и Т-лимфопоэз. Созревание лимфоцитов делится на два этапа.
Первый этап образования некоммитированных, или наивных, В-лимфоцитов происходит в костном мозге, Т-лимфоцитов — в костном мозге и тимусе, которые называются центральными органами иммунной системы. Это антиген-независимый этап.
Второй этап — антиген-зависимый, связанный с образованием иммунокомпетентных клеток, которые пролиферируют и дифференцируются в органах периферической иммунной системы: лимфатических узлах, белой пульпе селезенки, лимфатических фолликулах слизистых оболочек (созревание В-лимфоцитов). Созревание В-лимфоцитов в костном мозге сопряжено с запрограммированным повреждением участка ДНК, кодирующего вариабельные участки цепей иммуноглобулинов.
Механизм повреждения ДНК заключается в перестройке или спонтанной потере и случайном объединении фрагментов части VDJ-регионов гена иммуноглобулина (V — variable, вариабельный; D — diversity, разнообразие; J — joining, соединительный), в результате чего появляется уникальная для каждой В-клетки последовательность VDJ.
На первых этапах дифференцировки про-В-клеток происходит формирование уникальных VDJ-генов вариабельных участков тяжелых цепей иммуноглобулинов, позднее, на стадии пре-В-клеток — VJ-легких цепей, в которых отсутствует группа региона D. После перестройки вариабельного участка гена она соединяется с С (constant, константная) его частью. На этой же стадии синтезируется готовый цитоплазматический иммуноглобулин M, затем на стадии незрелого В-лимфоцита формируется поверхностный иммуноглобулин М, а на стадии зрелого В-лимфоцита — иммуноглобулины М и D, которые, действуя с дополнительными мембранными структурами, становятся В-клеточным рецептором (B-cell receptor, BCR), необходимым для распознавания антигенов.
Все иммуноглобулины М в цитоплазматической или мембранной стадии, в отличие от пентамерной секреторной его формы, являются мономерами. После указанных событий зрелые В-лимфоциты покидают костный мозг и направляются с током крови в один из трех видов периферических лимфоидных органов для дальнейшего созревания. Основной структурной единицей, где осуществляются обучение и отбор зрелых В-лимфоцитов, являются лимфоидные фолликулы.
Созревание Т-лимфоцитов происходит по тем же принципам, что и В-лимфоцитов, однако Т-лимфоциты покидают костный мозг, когда еще не являются зрелыми клетками. Все процессы изменений VDJ-регионов гена иммуноглобулина, который у Т-лимфоцитов присутствует только в виде мембранной структуры (совместно с CD4 или CD8) и поэтому называется Т-клеточным рецептором, в дальнейшем происходят в тимусе.
Моноцитопоэз
Наиболее ранние коммитированные предшественники мононуклеарных клеток имеют общее с гранулоцитами происхождение и называются гранулоцитарно-макрофагальными колониеобразующими единицами (ГМ-КОЕ), далее следуют специализированные макрофагальные единицы и уже морфологически идентифицируемые монобласты и промоноциты. Небольшая часть моноцитов дифференцируется в макрофаги костного мозга, остальные выходят в кровоток в виде моноцитов. Процесс дифференцировки и созревания клеток моноцитопоэза регулируется колониестимулирующими факторами (ГМ-КСФ, М-КСФ, ИЛ-3).
При подготовке данной статьи использованы:
Стуклов Н.И. “Учебник по гематологии” / Н.И. Стуклов, Г.И. Козинец, Н.Г. Тюрина. – М.: Практическая медицина, 2018. — 336 с.